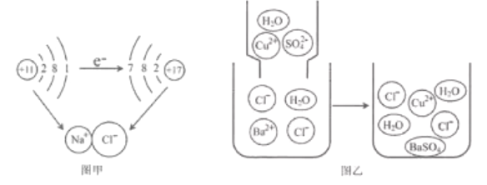
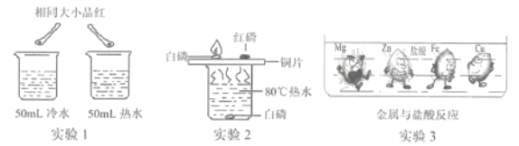
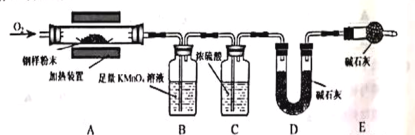
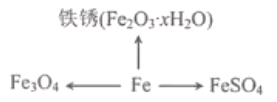题目内容
【题目】高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO + 2Fe(NO3)3 + 10NaOH = 2Na2FeO4↓+3NaCl +6NaNO3 + 5H2O
(1)在Fe(NO3)3中,铁元素和氮元素的质量比为 (填最简比)。
(2)县称取44.7g次氯酸钠,最多能制得高铁酸钠的质量是多少?(列式计算)
温馨提示:NaClO的相对分子质量为74.5;Na2FeO4的相对分子质量为166。
【答案】(1)4:3;⑵最多可得到高铁酸钾的质量为66.4g。
【解析】(1)在Fe(NO3)3中,铁元素和氮元素的质量比为∶56∶14×3=4:3;
(2)解:设高铁酸钠的质量为X
3NaClO + 2Fe(NO3)3 + 10NaOH = 2Na2FeO4↓+3NaCl +6NaNO3 + 5H2O
223.5 332
44.7g X
![]()
X=66.4g
答:最多可得到高铁酸钾的质量为66.4g。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目