题目内容
把干燥的高锰酸钾固体50g装入大试管中,加热制取氧气.待反应一段时间后停止加热,将试管冷却,称量得剩余物质的质量为45.2g.计算
(1)反应后生成多少克氧气?
(2)45.2g剩余物质中含有哪些物质?各是多少?
解:(1)由质量守恒定律可知氧气的质量=50g-45.2g=4.8g;
(2)设参加反应的KMnO4质量为x,反应生成的K2MnO4质量为y、MnO2质量分别为z.
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 197 87 32
x y z 4.8g
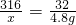
x=47.4g
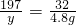
y=29.55g
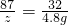
z=13.05g
剩余的高锰酸钾的质量为:50g-47.4g=2.6g
答:(1)反应中出生成4.8g氧气;
(2)45.2g剩余物质中含有高锰酸钾、锰酸钾、二氧化锰;其中剩余固体中高锰酸钾的质量是2.6g,锰酸钾的质量为29.55g,二氧化锰的质量为13.05g.
分析:高锰酸钾受热分解后生成锰酸钾、二氧化锰和氧气,由于氧气逸出,所以反应后固体质量会减少;根据质量守恒定律可知,固体质量的减少量即为生成氧气的质量,然后根据反应方程式由氧气的质量求出参加反应的高锰酸钾的质量、生成锰酸钾的质量、二氧化锰的质量.
点评:此题考查的根据关化学方程式的计算,通过认真分析题干,直接得到氧气的质量,然后再求高锰酸钾的质量.
(2)设参加反应的KMnO4质量为x,反应生成的K2MnO4质量为y、MnO2质量分别为z.
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑316 197 87 32
x y z 4.8g
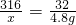
x=47.4g
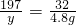
y=29.55g
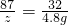
z=13.05g
剩余的高锰酸钾的质量为:50g-47.4g=2.6g
答:(1)反应中出生成4.8g氧气;
(2)45.2g剩余物质中含有高锰酸钾、锰酸钾、二氧化锰;其中剩余固体中高锰酸钾的质量是2.6g,锰酸钾的质量为29.55g,二氧化锰的质量为13.05g.
分析:高锰酸钾受热分解后生成锰酸钾、二氧化锰和氧气,由于氧气逸出,所以反应后固体质量会减少;根据质量守恒定律可知,固体质量的减少量即为生成氧气的质量,然后根据反应方程式由氧气的质量求出参加反应的高锰酸钾的质量、生成锰酸钾的质量、二氧化锰的质量.
点评:此题考查的根据关化学方程式的计算,通过认真分析题干,直接得到氧气的质量,然后再求高锰酸钾的质量.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目