题目内容
【题目】(6分)工业上生产电路板及处理废液的工艺流程如下:
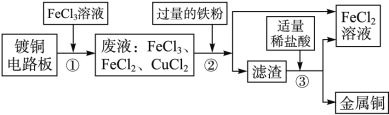
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是________和________。
(2)步骤②加入过量的铁粉,除能与废液中FeCl3反应外,还可发生的化学反应方程式为______________________。
(3)步骤③加入稀盐酸,充分搅拌,当观察到________________________时,说明滤渣只剩铜。
(4)步骤②③所得FeCl2可与一种单质发生化合反应生成FeCl3,实现循环使用。根据质量守恒定律可推测该单质的化学式为___________。
【答案】(1)FeCl2、CuCl2 ;(或CuCl2 、 FeCl2) ;(2)Fe+CuCl2===FeCl2+Cu ; (3)不再有气泡产生 ;(4)Cl2(化学方程式每个2分,其余每空1分,共6分);
【解析】
试题解析:该反应的流程是电路板中的铜和氯化铁反应生成氯化亚铁和氯化铜;过量的铁粉和氯化铁反应生成氯化亚铁、铁和氯化铜反应生成铜和氯化亚铁,铁过量则滤渣中含有铜和铁;向铁和铜的混合物中加入稀盐酸,铁和稀盐酸反应生成氯化亚铁,而铜和稀盐酸不反应,可以得到固体铜;(1)从废液的成分可以得出氯化铁和铜反应生成的物质有氯化亚铁和氯化铜;(2)铁排在铜之前,铁可以和氯化铜反应生成氯化亚铁和铜;(3)铁可以和稀盐酸反应生成氢气而铜和稀盐酸不反应,故看到无气泡冒出证明铁反应完全而只剩下铜;(4)氯化亚铁和一种单质发生化合反应生成氯化铁,根据反应中铁元素的化合价升高及化学反应前后元素的种类不变可以得出参加反应的是物质是氯气;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】长途运输鱼苗时,为了防止鱼苗缺氧,常在水中加入物质X,发生反应的化学方程式为:2X+2H2O=2Ca(OH)2+O2↑,其中X的化学式为
A.CaO B.CaO2 C.CaCO3 D.CaCl2