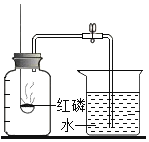
题目内容
【题目】下列实验现象及方程式均正确的是( )
A.铁丝在氧气中剧烈燃烧,火星四射:4Fe+3O2![]() 2Fe2O3
2Fe2O3
B.硫在氧气中燃烧,发出淡蓝色火焰:S+O2![]() SO2
SO2
C.铁丝放入硫酸铜溶液中,固体表面出现红色物质:3CuSO4+2Fe=3Cu+Fe2(SO4)3
D.红磷在空气中燃烧,产生大量的白烟:4P+5O2![]() 2P2O5
2P2O5
【答案】D
【解析】
A、铁丝在氧气中剧烈燃烧生成四氧化三铁,火星四射,反应的化学方程式为 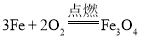 ,故A不正确;
,故A不正确;
B、硫在氧气中燃烧,发出蓝紫色火焰,反应的化学方程式为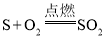 ,故B不正确;
,故B不正确;
C、铁丝放入硫酸铜溶液中生成硫酸亚铁和铜,固体表面出现红色物质,反应的化学方程式为![]() ,故C不正确;
,故C不正确;
D、红磷在空气中燃烧生成五氧化二磷,产生大量的白烟,反应的化学方程式为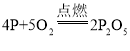 ,故D正确。故选D。
,故D正确。故选D。

【题目】长郡双语实验中学化学兴趣小组的同学将氢氧化钠溶液和稀硫酸混合,没有观察到明显的现象,他们对此提出了如下问题并进行了相应探究:
问题一:二者之间是否发生了反应?他们设计了如下方案证明二者之间确实发生了反应:
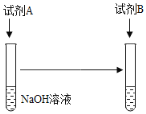
(1)可以选择的试剂组合有____________(填序号)。
①试剂A:足量稀硫酸,试剂B:MgCl2溶液
②试剂A:足量稀硫酸,试剂B:铁粉
③试剂A:少量稀硫酸,试剂B:MgCl2溶液
④试剂A:少量稀硫酸,试剂B:铁粉
(2)小玮认为:若选用_________溶液,不管加入顺序如何,只需控制加入稀硫酸的量也能证明二者发生了反应。
问题二:反应后溶液中溶质有哪些?
(猜想假设)猜想一:只有Na2SO4;猜想二:Na2SO4和NaOH;猜想三:Na2SO4和H2SO4。
(查阅资料)①Na2SO4溶液显中性,②Na2SO4+BaCl2=BaSO4↓+2NaCl。
(实验操作)分别取少量反应后的溶液于试管中,进行如下实验:
实验编号 | 实验过程 | 实验现象 |
① | 加入酚酞溶液 | 不变红 |
② | 加入少量BaCl2溶液 | 产生白色沉淀 |
③ | 加入少量(3)______溶液 | 没有气泡产生 |
(实验结论)猜想一成立。
(实验反思)小光认为,实验(4)________(填实验编号)可省略。小娟取少量反应后的溶液中于试管中,加入红色固体(5)___________(填化学式),观察到红色固体不溶解,也得出了相同结论。