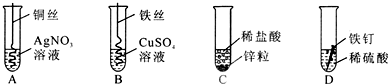
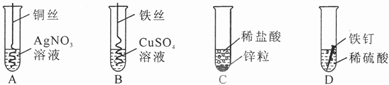
题目内容
如图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题: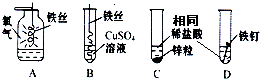
(1)描述A中的实验现象______.
(2)写出C中反应的化学方程式______.
(3)观察比较C、D中的实验现象,可以得出锌与铁两种金属中,______的活动性要强一些.
(4)开始反应后D中溶液逐渐变为黄色,原因是______.
解:(1)铁丝在氧气中的现象为:剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体;
(2)C中是锌与稀盐酸的反应,锌的活动性在氢的前面,所以锌与稀盐酸可以反应生成氢气,其反应的方程式为:Zn+2HCl═ZnC12+H2↑;
(3)根据实验的现象锌比铁和同种盐酸反应的剧烈,产生气泡的速率快,说明活动性锌>铁;
(4)从变黄色可推测溶液中含有铁离子,所以可猜想是铁钉表面有铁锈,铁锈的主要成分是氧化铁,所以会与稀硫酸反应生成硫酸铁,从而是溶液变黄;
故答案为:(1)铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体;
(2)Zn+2HCl═ZnC12+H2↑;(3)锌;(4)铁钉未打磨有铁锈反应生成硫酸铁黄色的溶液.
分析:(1)根据铁丝在氧气中燃烧的现象进行分析解答即可;
(2)在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)生成氢气,因此锌和盐酸反应,写出反应的方程式;
(3)根据两种金属与酸反应的剧烈程度分析活动性的强弱;
(4)根据黄色的溶液说明含有铁离子分析.
点评:本题以实验探究为主题,主要考查了金属的化学性质,要求学生要具有利用金属活动顺序的意义设计实验、分析实验的能力.
(2)C中是锌与稀盐酸的反应,锌的活动性在氢的前面,所以锌与稀盐酸可以反应生成氢气,其反应的方程式为:Zn+2HCl═ZnC12+H2↑;
(3)根据实验的现象锌比铁和同种盐酸反应的剧烈,产生气泡的速率快,说明活动性锌>铁;
(4)从变黄色可推测溶液中含有铁离子,所以可猜想是铁钉表面有铁锈,铁锈的主要成分是氧化铁,所以会与稀硫酸反应生成硫酸铁,从而是溶液变黄;
故答案为:(1)铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体;
(2)Zn+2HCl═ZnC12+H2↑;(3)锌;(4)铁钉未打磨有铁锈反应生成硫酸铁黄色的溶液.
分析:(1)根据铁丝在氧气中燃烧的现象进行分析解答即可;
(2)在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)生成氢气,因此锌和盐酸反应,写出反应的方程式;
(3)根据两种金属与酸反应的剧烈程度分析活动性的强弱;
(4)根据黄色的溶液说明含有铁离子分析.
点评:本题以实验探究为主题,主要考查了金属的化学性质,要求学生要具有利用金属活动顺序的意义设计实验、分析实验的能力.

练习册系列答案
相关题目