题目内容
【题目】第六组同学对上述部分反应前后物质的质量进行了称量,发现有的反应后物质质量增加、而有的质量减少。对此,该组同学展开进一步的定量探究,验证质量守恒定律。
(1)如图所示,实验前天平平衡。
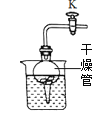
① 将注射器中适量的稀盐酸注入锥形瓶中,反应的化学方程式为______,观察到天平的指针_____(填“偏左”、“偏右”或“在标尺中央”,下同)。
② 上述实验的反应结束后,松开锥形瓶上的橡皮塞,天平的指针__________。
结论:为验证质量守恒定律,若有气体参与或生成的实验必须设计__________(“开放”或“密闭”)装置进行探究。
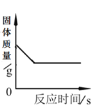
(2)某同学根据质量守恒定律研究物质W的组成。一定条件下,W在密闭容器内发生反应,反应前后各物质的质量如下图所示:
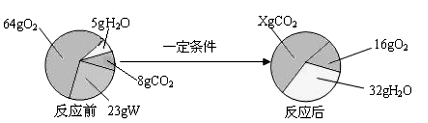
图中X =_______g。物质W由____种元素组成,其中碳、氢原子个数比为_________(填最简比)。
【答案】CaCO3+2HCl═CaCl2+CO2↑+H2O 在标尺中央 偏右 密闭 52 3 1:3
【解析】
(1)①大理石中的碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O,观察到天平的指针在标尺中央;
②上述实验的反应结束后,松开锥形瓶上的橡皮塞,反应生成的二氧化碳逸出装置,天平的指针偏右,结论:为验证质量守恒定律,若有气体参与或生成的实验必须设计密闭装置进行探究;
(2)图中X=23g+(64g-16g)-(32g-5g)+8g=52g;物质W中氧元素质量为:(52g-8g)×![]() +(32g-5g)×
+(32g-5g)×![]() -(64g-16g)=8g,因此W由碳元素、氢元素和氧元素等3种元素组成;其中碳元素、氢元素质量分别为:(52g-8g)×
-(64g-16g)=8g,因此W由碳元素、氢元素和氧元素等3种元素组成;其中碳元素、氢元素质量分别为:(52g-8g)×![]() =12g、(32g-5g)×
=12g、(32g-5g)×![]() =3g,碳、氢原子个数比为:
=3g,碳、氢原子个数比为:![]() :
:![]() =1:3。
=1:3。

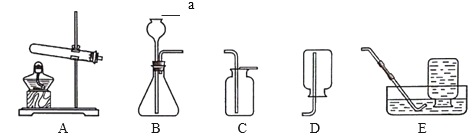
【题目】初三化学学习小组开展以下探究。(1)实验室制取常见气体
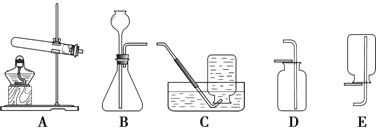
①用高锰酸钾制取氧气可用_____(填标号,下同),用双氧水制取氧气可用______,制取二氧化碳气体可用_____。
a.AC组合 b.BD组合 c.BE组合
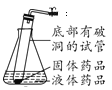
②如图所示是方方同学利用报废试管设计的制二氧化碳的发生装置,装置中反应的化学方程式为____。该设计除了废物利用的优点外,请另写一个优点:______。
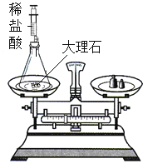
(2)同学们设计以下实验方案对“影响金属与盐酸反应剧烈程度的因素”进行了探究(盐酸的质量相同且足以把金属完全消耗)。
实验编号 | 金属 | 盐酸的质量分数/% | 温度/℃ | 金属丝消失的时间/s |
1 | 铝丝 | 5 | 20 | 450 |
2 | 铝丝 | 8 | 20 | t |
3 | 铝丝 | 10 | 20 | 240 |
4 | 铝丝 | 10 | 30 | 65 |
5 | 铁丝 | 10 | 30 | 125 |
①上表中还要注明控制的变量是_______。
②铝与盐酸反应的化学方程式为_______。
③实验1、2、3的目的是_____;在实验2中,铝丝消失的时间(用t表示)的取值范围是_____。
④为了比较盐酸与金属反应的剧烈程度,除了用金属丝消失的时间作为观测指标外,还可以选择___。
⑤由实验_____(填实验编号)可知,温度对金属与酸反应速率的影响是____。
⑥实验4、5说明金属与盐酸反应剧烈程度与金属的种类有关,通过这两个实验可知铝的活泼性比铁____(填“强”或“弱”)。