题目内容
(2011年湖南邵阳,32题)某化学兴趣小组的同学在老师的带领下参观如图所示的炼铁厂。小新想用自己所学知识来测定产品中铁的质量分数,征得工人师傅同意,带回一小块生铁样品。称得该样品6.0g,放入烧杯中,向其中逐滴加入稀盐酸,当滴入54.0g稀盐酸时,反应不再产生气泡(假设杂质不参与反应),称得烧杯内剩余物质的总质量为59.8g。(铁与稀盐酸反应的化学方程式为Fe+2HCl=FeCl2+H2↑)请你帮小新完成有关计算(结果保留一位小数):
(1)实验产生氢气的质量是 g。
(2)生铁样品中铁的质量分数。
解:根据质量守恒定律可知:
生铁与酸反应时生成的氢气的质量是:6.0+54.0g-59.8g=0.2g
设生铁中铁的质量是x
Fe + 2HCl = FeCl2 + H2↑
56 2
X 0.2g
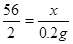 x=
x=
生铁中铁的质量分数是: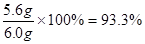
答:实验中产生氢气的质量是0.2g,生铁样品中铁的质量分数是93.3%。解析:
略
生铁与酸反应时生成的氢气的质量是:6.0+54.0g-59.8g=0.2g
设生铁中铁的质量是x
Fe + 2HCl = FeCl2 + H2↑
56 2
X 0.2g
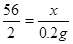 x=
x=
生铁中铁的质量分数是:
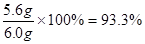
答:实验中产生氢气的质量是0.2g,生铁样品中铁的质量分数是93.3%。解析:
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 33、2011年湖南邵阳初中毕业化学实验操作技能考查中,小波抽到的试题是“水的净化”,请你与小波一起实验,并回答下列问题
33、2011年湖南邵阳初中毕业化学实验操作技能考查中,小波抽到的试题是“水的净化”,请你与小波一起实验,并回答下列问题

