题目内容
现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案:

[实验数据]实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为
(2)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为
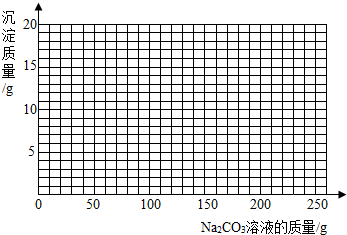
(3)若在100g混合溶液中不断加入10.6% 的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图.(在答题卡的坐标图中作图)
(4)混合溶液中CaCl2的质量分数为多少?(写出计算过程)


[实验数据]实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为
7.3%
7.3%
.(只写结果)(2)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为
8.2%
8.2%
.(不考虑过滤中的损失.只写结果,保留小数点后一位)(3)若在100g混合溶液中不断加入10.6% 的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图.(在答题卡的坐标图中作图)
(4)混合溶液中CaCl2的质量分数为多少?(写出计算过程)

分析:(1)根据2HCl+Na2CO3=NaCl+H2O+CO2↑和气体吸收完全后,NaOH溶液质量增加4.4g,生成的二氧化碳的质量为4.4g,求出HCl的质量,再根据溶质质量分数的公式求出.
(2)根据2HCl+Na2CO3=2NaCl+H2O+CO2↑,求出NaCl的质量;然后根据质量守恒定律求出所得溶液的质量,根据溶质质量分数公式求出溶质质量分数.
(2)根据2HCl+Na2CO3=2NaCl+H2O+CO2↑,求出NaCl的质量;然后根据质量守恒定律求出所得溶液的质量,根据溶质质量分数公式求出溶质质量分数.
解答:解:(1)设稀盐酸中溶质氯化氢的质量为x,生成的氯化钠的质量为y,所需碳酸钠的质量为z.
2HCl+Na2CO3=2NaCl+H2O+CO2↑
73 106 117 44
x z y 4.4g
=
x=7.3g
=
y=11.7g
稀盐酸中溶质质量分数为:
×100%=7.3%
=
z=10.6g
所加碳酸钠溶液的质量为10.6g÷10.6%=100g
(2)设混合溶液中CaCl2的质量为x,生成氯化钠的质量为y,和氯化钙反应的碳酸钠的质量为a.
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
x a 10g y
=
x=11.1g
=
y=11.7g
=
a=10.6g
所以和氯化钙反应的碳酸钠溶液的质量
=100g
所得滤液中氯化钠的质量为11.7g+11.7g=23.4g,滤液的质量为100g+200g-4.4g-10g=285.6g
所得滤液中溶质的质量分数为
×100%=8.2%
(3)碳酸钠先和稀盐酸反应不产生沉淀,稀盐酸反应完后碳酸钠再和氯化钙反应生成碳酸钙沉淀,稀盐酸消耗碳酸钠溶液的质量为100g,和氯化钙反应的碳酸钠溶液的质量为100g,再加碳酸钠氯化钙已被消耗不会再产生沉淀.故作图见右图曲线(共1分)
(4)解:设混合溶液中CaCl2的质量为x.
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 100
x 10g
=
x=11.1g
混合溶液中CaCl2的质量分数=(11.1g÷100g)×100%=11.1%
答:混合溶液中CaCl2的质量分数为11.1%.
2HCl+Na2CO3=2NaCl+H2O+CO2↑
73 106 117 44
x z y 4.4g
| 73 |
| x |
| 44 |
| 4.4g |
| 117 |
| y |
| 44 |
| 4.4g |
稀盐酸中溶质质量分数为:
| 7.3g |
| 100g |
| 106 |
| z |
| 44 |
| 4.4g |
所加碳酸钠溶液的质量为10.6g÷10.6%=100g
(2)设混合溶液中CaCl2的质量为x,生成氯化钠的质量为y,和氯化钙反应的碳酸钠的质量为a.
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
x a 10g y
| 111 |
| 100 |
| x |
| 10g |
| 117 |
| y |
| 100 |
| 10g |
| 106 |
| a |
| 100 |
| 10g |
a=10.6g
所以和氯化钙反应的碳酸钠溶液的质量
| 10.6g |
| 10.6% |
所得滤液中氯化钠的质量为11.7g+11.7g=23.4g,滤液的质量为100g+200g-4.4g-10g=285.6g
所得滤液中溶质的质量分数为
| 23.4g |
| 285.6g |
(3)碳酸钠先和稀盐酸反应不产生沉淀,稀盐酸反应完后碳酸钠再和氯化钙反应生成碳酸钙沉淀,稀盐酸消耗碳酸钠溶液的质量为100g,和氯化钙反应的碳酸钠溶液的质量为100g,再加碳酸钠氯化钙已被消耗不会再产生沉淀.故作图见右图曲线(共1分)

(4)解:设混合溶液中CaCl2的质量为x.
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 100
x 10g
| 111 |
| 100 |
| x |
| 10g |
x=11.1g
混合溶液中CaCl2的质量分数=(11.1g÷100g)×100%=11.1%
答:混合溶液中CaCl2的质量分数为11.1%.
点评:溶液和化学反应融合的题目,是综合性的题型,要求比较高.通常学生在计算时常常会忽视了实际参加反应的是溶液中溶质的质量.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
 12、常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
12、常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )