题目内容
【题目】为探究Fe、Cu、Ag的金属活动性强弱,某兴趣小组做了如下实验:
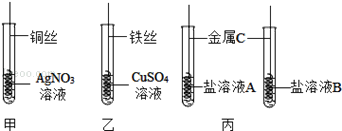
(1)实验前需将金属丝打磨,目的是_________________________。
(2)甲实验中发生反应的化学方程式为___________________________________。
(3)乙实验中观察到的现象为___________________________________________。
(4)通过甲、乙实验探究,可得出三种金属活动性由强到弱的顺序为___________。
(5)若采用丙实验方案也可得出相同结论,则金属C是______________________。
【答案】 除去表面的氧化物,以免影响反应 Cu + 2AgNO3 == Cu (NO3 )2 + 2Ag 铁丝表面有红色固体析出,溶液由蓝色变成浅绿色 铁、铜、银 铜
【解析】(1)金属丝表面有氧化物,打磨可除去表面的氧化物,以免影响反应。(2)甲实验中发生反应的化学方程式为 Cu + 2AgNO3 == Cu (NO3 )2 + 2Ag(3)生成的金属附着在原来金属的表面,硫酸铜溶液是蓝色的,硫酸亚铁溶液是浅绿色的,故观察到的现象为铁丝表面有红色固体析出,溶液由蓝色变成浅绿色 。(4)通过甲的实验探究,得出铜>银,通过乙的实验探究,得出铁>铜,故三种金属活动性由强到弱的顺序为铁>铜>银。(5)探究三种金属的活动性顺序,可用中间金属单质与另外两种金属的盐溶液反应,故C是铜。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目