题目内容
现有下列实验装置,请根据要求回答:
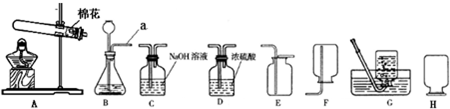
(1)仪器a的名称是:
(2)实验室若使用盐酸和金属锌制取氢气,化学反应方程式为
(3)写出使用AE 装置制取气体的化学反应方程式: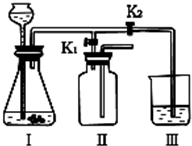
(4)该小组设计了如图所示的实验装置,既可用于制取气体,又可用于探究物质性质.
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
a.大理石与稀盐酸反应制取收集二氧化碳
b.锌与稀硫酸反应制取收集氢气
c.用氯酸钾与二氧化锰共同加热制取收集氧气
②当打开K2、关闭K1时,可以利用Ⅰ、Ⅲ装置制得二氧化碳并验证其性质.若要证明二氧化碳能与水发生反应,应向烧杯的水中加入

(1)仪器a的名称是:
导气管
导气管
.(2)实验室若使用盐酸和金属锌制取氢气,化学反应方程式为
Zn+2HCl=ZnCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
,这种方法制得的氢气往往含有少量氯化氢气体,原因是盐酸有挥发性
盐酸有挥发性
,可将气体通过装置C
C
除去氯化氢气体;集满氢气后的集气瓶按装置H方式放置备用,原因是氢气密度比空气小,以防逸出
氢气密度比空气小,以防逸出
.(3)写出使用AE 装置制取气体的化学反应方程式:
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||

(4)该小组设计了如图所示的实验装置,既可用于制取气体,又可用于探究物质性质.
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
b
b
(填字母).a.大理石与稀盐酸反应制取收集二氧化碳
b.锌与稀硫酸反应制取收集氢气
c.用氯酸钾与二氧化锰共同加热制取收集氧气
②当打开K2、关闭K1时,可以利用Ⅰ、Ⅲ装置制得二氧化碳并验证其性质.若要证明二氧化碳能与水发生反应,应向烧杯的水中加入
紫色的石蕊试液
紫色的石蕊试液
.分析:(1)根据仪器的用途写出名称;
(2)锌和盐酸反应生成氯化锌和氢气,盐酸具有挥发性,易与碱性物质反应,氢气的密度比空气小;
(3)根据AE的发生装置和收集装置的特点分析适合制取固固加热型且密度比空气大的气体;
(4)①根据发生装置的特点和收集方法选择;
②二氧化碳能与水发生反应生成碳酸,显酸性,可以用石蕊试液检验.
(2)锌和盐酸反应生成氯化锌和氢气,盐酸具有挥发性,易与碱性物质反应,氢气的密度比空气小;
(3)根据AE的发生装置和收集装置的特点分析适合制取固固加热型且密度比空气大的气体;
(4)①根据发生装置的特点和收集方法选择;
②二氧化碳能与水发生反应生成碳酸,显酸性,可以用石蕊试液检验.
解答:解:(1)a是用于导气的导气管;故答案为:导气管;
(2)锌和盐酸反应生成氯化锌和氢气,g故反应的方程式为:Zn+2HCl=ZnCl2+H2↑;因为盐酸具有挥发性,会使制得的氢气中混有氯化氢杂质;而氯化氢易与碱性物质反应,故可以用氢氧化钠溶液吸收;因为氢气的密度比空气小,所以要倒放,以防氢气的溢出;
故答案为:Zn+2HCl=ZnCl2+H2↑ 盐酸有挥发性 C 氢气密度比空气小,以防逸出;
(3)使用AE 装置制取的气体是氧气,用高锰酸钾加热生成锰酸钾、二氧化锰和氧气,故反应的方程式为:2KMnO4
K2MnO4+MnO2+O2↑;
(4)①利用I、Ⅱ装置制取的气体应该是固液常温型的,排除c;收集方法是适合密度比空气小的气体,排除a,故选在b;
②二氧化碳能与水发生反应生成碳酸,可以使紫色的石蕊试液变成红色;
故答案为:①b ②紫色的石蕊试液
(2)锌和盐酸反应生成氯化锌和氢气,g故反应的方程式为:Zn+2HCl=ZnCl2+H2↑;因为盐酸具有挥发性,会使制得的氢气中混有氯化氢杂质;而氯化氢易与碱性物质反应,故可以用氢氧化钠溶液吸收;因为氢气的密度比空气小,所以要倒放,以防氢气的溢出;
故答案为:Zn+2HCl=ZnCl2+H2↑ 盐酸有挥发性 C 氢气密度比空气小,以防逸出;
(3)使用AE 装置制取的气体是氧气,用高锰酸钾加热生成锰酸钾、二氧化锰和氧气,故反应的方程式为:2KMnO4
| ||
(4)①利用I、Ⅱ装置制取的气体应该是固液常温型的,排除c;收集方法是适合密度比空气小的气体,排除a,故选在b;
②二氧化碳能与水发生反应生成碳酸,可以使紫色的石蕊试液变成红色;
故答案为:①b ②紫色的石蕊试液
点评:本题主要考查了气体的制取,通过回答既考查了学生的分析问题的能力,有考查了学生的实验探究能力.

练习册系列答案
相关题目



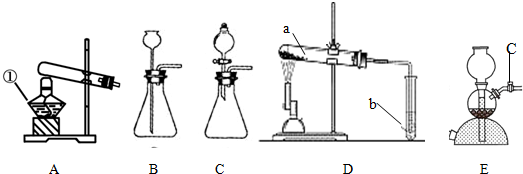
 装置进行“排空气法”收集制取的CO2,请把图中的“导气管”补画完整.
装置进行“排空气法”收集制取的CO2,请把图中的“导气管”补画完整.