题目内容
一定质量的某金属R与足量的盐酸反应,可生成0.25g的H2.1.6倍该物质的金属R与21.3gCl2可恰好完全反应生成相应的氯化物.已知金属元素R在某氧化物中的化合价和上述一种氯化物的化合价相同,且氧化物的相对分子质量为金属的相对原子质量的
倍.求该氧化物的化学式.
| 20 | 7 |
分析:解答时可以设金属R和与盐酸,以及与氯气反应生成了两种不同价态的化合物,然后写出它们的化学方程式,再设出金属R的质量结合结合氢气的质量及反应掉的氯气的质量进行计算即可.
解答:解:由于在氯化物中氯元素的化合价为-1价,所以设金属R与盐酸和氯气分别反应生成的氯化物的化学式为RClx和RCly,其中x和y分别为金属R表现出来的化合价,则其化学方程式分别为:2R+2xHCl═2RClx+xH2↑,2R+yCl2═2RCly,再设金属R的相对原子质量为M,与盐酸反应生成0.25g H2时消耗金属R的质量为m,
则由题意可得:2R+2xHCl═2RClx+xH2↑,2R+yCl2═2RCly
2M 2x 2M 71y
m 0.25g 1.6m 21.3g
=
…①
=
…②
联立①②可以得出:
=
解得:
=
所以可以判断金属R的化合价分别为+2和+3,其相应的氧化物的化学式为RO;R2O3.当所求化学式为RO时,M+16=
M,即M≈8.6,无对应的金属,故不合题意,应舍去;当所求化学式为R2O3时,2M+16×3=
M,所以M=56,即R为铁.所求氧化物的化学式为Fe2O3.
故答案为:Fe2O3.
则由题意可得:2R+2xHCl═2RClx+xH2↑,2R+yCl2═2RCly
2M 2x 2M 71y
m 0.25g 1.6m 21.3g
| 2M |
| m |
| 2x |
| 0.25g |
| 2M |
| 1.6m |
| 71y |
| 21.3g |
联立①②可以得出:
| 2x |
| 0.25g |
| 71y |
| 21.3g |
解得:
| x |
| y |
| 2 |
| 3 |
所以可以判断金属R的化合价分别为+2和+3,其相应的氧化物的化学式为RO;R2O3.当所求化学式为RO时,M+16=
| 20 |
| 7 |
| 20 |
| 7 |
故答案为:Fe2O3.
点评:要想解答好这类题目,首先,要理解和熟记有关化学式的计算和推断方法,以及与之相关的知识.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意按照题目要求进行认真地选择或解答即可.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
(5分) 金属在日常生活中随处可见,研究金属的性质可以更好地利用金属。
(1)某兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
①将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
②将金属R投入到FeSO4溶液中,金属R表面有黑色物质析出。根据上述信息,判断金属Fe、R、Cu活动性由强到弱的顺序是 。
(2)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈,写出盐酸除铁锈反应的化学方程式 ;
(3)将一定量铁粉加入到硫酸锌、硫酸铜的混合液中,充分反应后过滤。滤液中的溶质一定有 。
(4)取一定量镁、锌、铁三种金属,分别加入溶质质量分数相等的稀盐酸,充分反应后,生成氢气的质量相等。下列做法与此结果相符的是 (填序号)。
| A.相同质量的三种金属与足量的稀盐酸反应 |
| B.2.4 g镁、6.5 g锌、5.6 g铁与足量的稀盐酸反应 |
| C.向足量的镁、锌、铁中加入稀盐酸的质量比为2︰3︰2 |
| D.足量的三种金属与等量的稀盐酸反应 |
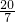 倍.求该氧化物的化学式.
倍.求该氧化物的化学式.