题目内容
【题目】化学竞赛周之前小胖想对所学知识进行总结,请你和他一起完成如下总结:
A.工业炼铁
(1)工业炼铁是利用一氧化碳将铁矿石中的铁还原出来,如下图是实验室模拟炼铁原理。实验过程中可以观察到的现象是:__________,硬质玻璃管中发生的化学反应方程式是_________________。小胖说应该在酒精灯上加一个灯罩,酒精灯罩的作用是_______________。
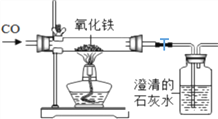
(2)实验过程中应该先______________(填“点燃酒精灯”或“通入CO”),其目的是 ______________。实验结束后,小胖说应该先关闭硬质玻璃管和澄清石灰水之间的止水夹,否则石灰水倒吸使试管炸裂,小华觉得他分析的不正确,其理由是______________________________。
(3)从环保的角度来分析,该装置存在的不足是____________,应做出的改进是______________。
(4)实验完成后,发现过量的澄清石灰水增重4.4g,则通入装置的CO气体质量肯定大于_______g,其理由是________________________________________________________ 。
B.侯氏制碱法
我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:
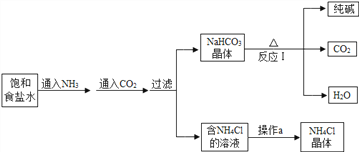
(1)请写出食盐水、氨气、二氧化碳反应的化学方程式______________。 分析下表,反应后能得到碳酸氢钠的晶体的原因是________________________________________。
物质 | 氯化钠 | 氯化铵 | 碳酸氢钠 | 碳酸氢铵 |
溶解度(20℃) | 36g | 37.2g | 8.5g | 29.8g |
(2)写出反应I的化学方程式 ___________________________;该反应的基本类型为 __________。
(3)操作a的过程是蒸发浓缩、___________ 、过滤、干燥。
(4)老师告诉小胖在通二氧化碳的时候最好采用加压的方法,小胖百思不得其解,你觉得这样做的 目的是:___________________。
(5)上述工艺流程中可循环利用的物质是______________ 。得到的氯化铵可以用作_____________。
【答案】 红色粉末逐渐变黑,澄清石灰水变浑浊 3CO+Fe2O3 ![]() 2Fe +3CO2 集中火焰,提高温度 通入CO 排尽空气,防止加热时发生爆炸 实验结束会一直通一氧化碳至装置冷却,石灰水不会倒吸 未处理尾气,污染空气 在石灰水后用酒精灯点燃尾气或用气球收集尾气 2.8 部分一氧化碳没有参加反应 NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl 20℃时碳酸氢钠的溶解度最小,先饱和析出固体 2NaHCO3
2Fe +3CO2 集中火焰,提高温度 通入CO 排尽空气,防止加热时发生爆炸 实验结束会一直通一氧化碳至装置冷却,石灰水不会倒吸 未处理尾气,污染空气 在石灰水后用酒精灯点燃尾气或用气球收集尾气 2.8 部分一氧化碳没有参加反应 NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl 20℃时碳酸氢钠的溶解度最小,先饱和析出固体 2NaHCO3![]() Na2CO3+CO2↑+H2O↑ 分解反应 冷却结晶 压强增大,二氧化碳气体溶解度增大 CO2和H2O 氮肥
Na2CO3+CO2↑+H2O↑ 分解反应 冷却结晶 压强增大,二氧化碳气体溶解度增大 CO2和H2O 氮肥
【解析】A.工业炼铁
(1)工业炼铁是利用一氧化碳和氧化铁反应生成铁和二氧化碳,实验过程中可以观察到的现象是:红色粉末逐渐变黑,澄清石灰水变浑浊,化学反应方程式是3CO+Fe2O3 ![]() 2Fe +3CO2 。酒精灯罩的作用是集中火焰,提高温度,以达到高温条件。(2)点燃或加热可燃性气体和空气的混合物可能发生爆炸。实验过程中应该先通入CO,其目的是排尽空气,防止加热时发生爆炸。实验结束后,会一直通一氧化碳至装置冷却,玻璃管内压强不会变小,石灰水不会倒吸。(3)从环保的角度来分析,一氧化碳是空气污染物,实验产生的尾气中有未反应的一氧化碳,而该装置存未处理尾气,会污染空气,应做出的改进是在石灰水后用酒精灯点燃尾气或用气球收集尾气。(4) 由Fe2O3+3CO 高温2Fe+3CO2可知一氧化碳和二氧化碳的质量比为:28:44,,实验完成后,发现过量的澄清石灰水增重4.4g,说明石灰水吸收二氧化碳4.4g,则通入装置的CO气体质量肯定大于2.8g,其理由是因为实验开始要通入一氧化碳排装置内的空气,实验结束后要继续通入一氧化碳防止铁被氧化,同时还有反应中剩余的一氧化碳。B.(1)请写出食盐水、氨气、二氧化碳反应的化学方程式为:NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl;(2)反应I为碳酸氢钠受热分解生成二氧化碳、了、碳酸钠、和水,化学方程式 2NaHCO3
2Fe +3CO2 。酒精灯罩的作用是集中火焰,提高温度,以达到高温条件。(2)点燃或加热可燃性气体和空气的混合物可能发生爆炸。实验过程中应该先通入CO,其目的是排尽空气,防止加热时发生爆炸。实验结束后,会一直通一氧化碳至装置冷却,玻璃管内压强不会变小,石灰水不会倒吸。(3)从环保的角度来分析,一氧化碳是空气污染物,实验产生的尾气中有未反应的一氧化碳,而该装置存未处理尾气,会污染空气,应做出的改进是在石灰水后用酒精灯点燃尾气或用气球收集尾气。(4) 由Fe2O3+3CO 高温2Fe+3CO2可知一氧化碳和二氧化碳的质量比为:28:44,,实验完成后,发现过量的澄清石灰水增重4.4g,说明石灰水吸收二氧化碳4.4g,则通入装置的CO气体质量肯定大于2.8g,其理由是因为实验开始要通入一氧化碳排装置内的空气,实验结束后要继续通入一氧化碳防止铁被氧化,同时还有反应中剩余的一氧化碳。B.(1)请写出食盐水、氨气、二氧化碳反应的化学方程式为:NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl;(2)反应I为碳酸氢钠受热分解生成二氧化碳、了、碳酸钠、和水,化学方程式 2NaHCO3![]() Na2CO3+CO2↑+H2O↑;该反应的基本类型为 由一种物质生成两种或两种以上物质的分解反应。(3)操作a的过程是蒸发浓缩、冷却结晶、过滤、干燥,得到较纯净的氯化铵固体(4)增多压强可以增大二氧化碳的溶解度,提高溶液中二氧化碳的浓度,有利于提高反应速率和产率。(5)上述工艺流程中CO2和H2O即是原料又是生成物,可循环利用。得到的氯化铵因含有氮元素可以用作氮肥。
Na2CO3+CO2↑+H2O↑;该反应的基本类型为 由一种物质生成两种或两种以上物质的分解反应。(3)操作a的过程是蒸发浓缩、冷却结晶、过滤、干燥,得到较纯净的氯化铵固体(4)增多压强可以增大二氧化碳的溶解度,提高溶液中二氧化碳的浓度,有利于提高反应速率和产率。(5)上述工艺流程中CO2和H2O即是原料又是生成物,可循环利用。得到的氯化铵因含有氮元素可以用作氮肥。

 阅读快车系列答案
阅读快车系列答案