题目内容
【题目】二氧化锰因在工业生产中应用广泛而备受关注,制取二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:(1)3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O
(2)K2MnO4易溶于水
实验室加热高锰酸钾制氧气,反应的化学方程式为__________,其反应类型是________;将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是__________。
Ⅱ.用硫酸锰制备
电解 MnSO4水溶液可制得MnO2,同时生成氢气和H2SO4,该反应的化学方程式为_________
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂回收,流程如下:
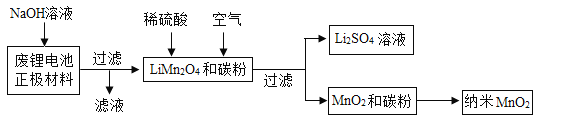
请回答下列问题:
(1)“滤液”中溶质的主要成分是____________(填化学式);
(2)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、玻璃棒和__________;
(3)MnO2与碳粉经下列三步反应制得纳米MnO2
①2MnO2+C![]() MnO+CO2↑
MnO+CO2↑
②MnO2+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有___________(填序号)。
【答案】2KMnO4 ![]() K2MnO4+MnO2+O2↑ 分解反应 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰 MnSO4+2H2O
K2MnO4+MnO2+O2↑ 分解反应 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰 MnSO4+2H2O![]() H2↑+H2SO4+ MnO2↓ NaAlO2 漏斗 ①③
H2↑+H2SO4+ MnO2↓ NaAlO2 漏斗 ①③
【解析】
Ⅰ.(2)高锰酸钾在加热条件下,发生分解反应生成锰酸钾、二氧化锰、氧气,反应的化学方程式为:2KMnO4 ![]() K2MnO4+MnO2+O2↑,由一种物质发生化学反应生成两种或两种以上物质的反应是分解反应。锰酸钾能与稀硫酸反应生成二氧化锰,用稀硫酸而不用水浸取的原因是为了获得更多的二氧化锰。
K2MnO4+MnO2+O2↑,由一种物质发生化学反应生成两种或两种以上物质的反应是分解反应。锰酸钾能与稀硫酸反应生成二氧化锰,用稀硫酸而不用水浸取的原因是为了获得更多的二氧化锰。
Ⅱ.根据题意,反应的化学方程式为:MnSO4+2H2O![]() H2↑+H2SO4+ MnO2↓
H2↑+H2SO4+ MnO2↓
Ⅲ.(1)由题给信息知道,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所以滤液中溶质的主要成分是NaAlO2
(2)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、玻璃棒和漏斗。
(3)①2MnO2+C![]() MnO+CO2↑,Mn元素、碳元素的化合价发生了变化,此选项符合题意;②MnO2+H2SO4=MnSO4+H2O,是复分解反应,发生复分解反应时,元素的化合价不变,此选项不符合题意;③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4,该反应中Mn元素的化合价有变化,此选项符合题意。故选①③。
MnO+CO2↑,Mn元素、碳元素的化合价发生了变化,此选项符合题意;②MnO2+H2SO4=MnSO4+H2O,是复分解反应,发生复分解反应时,元素的化合价不变,此选项不符合题意;③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4,该反应中Mn元素的化合价有变化,此选项符合题意。故选①③。

 阅读快车系列答案
阅读快车系列答案【题目】化学的研究和学习,需要构建合理的微观模型,并设置合适的化学符号为工具,用来研究和表述宏观化学物质的性质和变化。
(一)化学方程式的书写是学好化学的关键,但是很多同学在刚刚学习化学方程式书写时,常常会犯一些错误,具体概括如下:
①生成物化学式书写错误②未配平③遗漏反应条件④“↑”或“↓”使用不当请你判断下列化学方程式的错误类型(填序号)。
序号 | 化学方程式 | 错误类型 |
(1) | 镁条燃烧: | ______ |
(2) | 用硫酸铜溶液和氢氧化钠溶液混合:CuSO4+NaOH==Na2SO4+Cu(OH)2↓ | ______ |
(3) | 高炉冶炼赤铁矿: | ______ |
(二)试选用“>”或“<”或“=”填空。
(4)合金的硬度:一般情况下,合金______其成分金属。
(5)通常状况下的液体体积:100mL酒精与100mL水混合后的体积_____200mL。
(6)1g硫粉在1g氧气中完全燃烧后生成二氧化硫的质量______2g。
(三)(7)在做与燃烧有关的实验中,小明同学发现红磷的着火点是240℃,而白磷的着火点是40℃。由此我们可以判断:“由一种元素组成的物质叫做单质”这个说法有漏洞。请说明理由:____________。
【题目】SO2是一种无色有刺激性气味的气体,可以用于葡萄酒和果酒的酸造,SO2在性质上和CO2有一定的相似性,又有一定的差异。现通过实验探究如下:
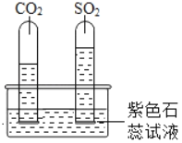
实验一:在装有水的水槽中滴入紫色石蕊试液,分别将收集满两种气体的试管同时倒立其中,片刻后实验现象如图所示,说明相同条件下SO2在水中的溶解能力_____CO2(填“强于”或“弱于”),试管内液体都变成_____色,左侧试管中发生反应的符号表达式为_____。
实验二:某实验产生的气体可能含有CO2和SO2中的一种或两种。
(提出问题)该气体是什么气体呢?
(查阅资料)SO2能使酸性高锰酸钾溶液褪色,同时被高锰酸钾溶液吸收。CO2则不与酸性高锰酸钾溶液反应。
(实验探究)
为验证该气体的成分,设计方案如表:
实验步骤 | 实验现象 | 实验结论 |
①将气体缓慢通入足量的酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液_____ | 气体中含有_____ |
②继续将剩余气体缓慢通入澄清石灰水中 | _____ | 气体中含有_____ |
结论:实验产生的气体为CO2和SO2的混合气体,实验步骤②中发生反应的符号表达式为_____。
(反思拓展)
(1)CO2和SO2的化学性质存在差异的微观原因是_____不同。
(2)科学告诉我们:化学反应前后反应物和生成物应该含有相同的元素。由此推断此气体可能来自_____反应生成。
A.铜和硫酸 B.碳和盐酸 C.碳和硫酸