题目内容
【题目】水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)如图是超市里一种盐汽水的营养成分表。
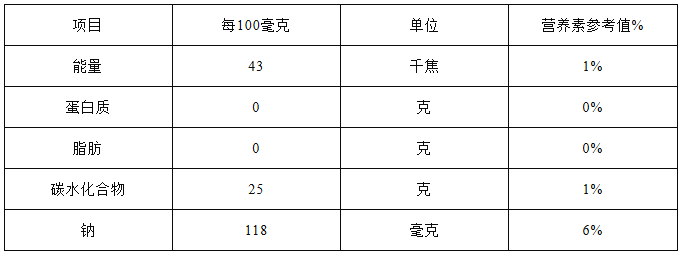
①该汽水含人体所需的六大营养素中的________种。
②“钠118毫克”是指____ (填“钠单质”或“钠元素”)的质量。
③常温下打开该汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与_________有关。
(2)如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
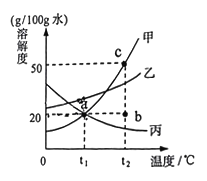
①t1℃时,甲、乙、丙三种物质的溶解度大小关系____________。
②t1℃时,完全溶解5g丙物质至少需要水________g。
③t2℃时,将20g甲加入到100g水中,充分搅拌后所得溶液是甲的____________溶液(填“饱和”或“不饱和”),可以用图中_______________点(填“a”、“b”、“c”)表示。
④将甲、丙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述不正确的是______________。
A.都是饱和溶液
B.溶剂质量:甲<丙
C.析出固体质量:甲>丙
D.溶质质量分数:甲=丙
【答案】 3 钠元素 压强 乙>甲=丙 25 不饱和 b ABD
【解析】(1)①根据人体所需的六大营养素分析;
②根据元素概念分析;
③根据影响气体溶解度的因素分析;
(2)①根据溶解度曲线分析;
②根据物质的溶解度分析;
③根据饱和溶液分析;
④饱和溶液与不饱和溶液相互转化过程中量的变化分析。
解:(1)①含该汽水含人体所需的六大营养素中的糖类、无机盐、水,3种。
②为生活中的宏观概念,不可能是单质钠,那么就是元素钠了
③常温下打开该汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与压强有关;
(2)①根据溶解度曲线可知,t1℃时,甲、乙、丙三种物质的溶解度大小关系是乙>甲=丙;
②t1℃时,丙的溶解度是20g。完全溶解5g丙物质至少需要水100g×5g÷20g=25g;
③t2℃时,甲的溶解度是50g。将20g甲加入到100g水中,充分搅拌后所得溶液是甲的不饱和溶液,可以用图中b点表示;
④甲物质的溶解度随温度的升高而增大,乙物质的溶解度随温度的升高而降低。将甲、丙的饱和溶液从t2℃降温到t1℃,甲物质有晶体析出,仍然是饱和溶液,溶剂质量不变,溶质质量分数变小。丙物质无晶体析出,变成不饱和溶液,溶剂质量不变,溶质质量分数不变。
A.都是饱和溶液,错误;
B.由于t2℃时甲丙饱和溶液的质量不清楚。故溶剂质量:甲<丙,无法判断,错误;
C. 将甲、丙的饱和溶液从t2℃降温到t1℃,甲物质有晶体析出,丙物质无晶体析出,故析出固体质量:甲>丙,正确;
D. 据饱和时质量分数的计算式![]() ×100%,可知溶解度越大质量分数也就越大,将甲、丙的饱和溶液从t2℃降温到t1℃,溶质质量分数:甲>丙,错误。
×100%,可知溶解度越大质量分数也就越大,将甲、丙的饱和溶液从t2℃降温到t1℃,溶质质量分数:甲>丙,错误。
故填ABD。

 小学教材全测系列答案
小学教材全测系列答案【题目】碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量的NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。
(1)反应的总反应方程式为TeOSO4 + 2SO2 + 3__X__ ![]() Te↓+ 3H2SO4,则X为_________(填化学式)
Te↓+ 3H2SO4,则X为_________(填化学式)
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 | 温度/℃ | 反应时间/h | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
①该小组研究的反应条件是_________________和_____________。
②实验a和b的目的是______________________________。
③在上述四组实验中,最佳的反应条件是_______℃和_______h。
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率。若再设计对比实验,选择的反应条件还可以是__________(填选项)。
A.80℃,1.5h B.80℃,2.5h C.70℃,2.0h D.95℃,2.0h