题目内容
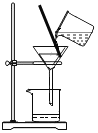
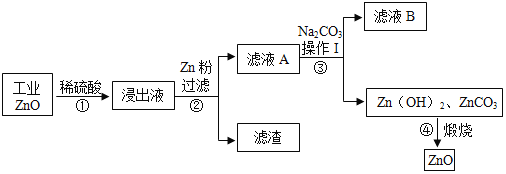
【题目】氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。用工业氧化锌(含有FeO、CuO杂质)生产纯氧化锌的流程如下:
请回答下列问题:
(1)写出浸出液中的阳离子:______;
(2)步骤②中发生了两个反应,都属于______(填基本反应类型)。
(3)从除杂原理分析,步骤②中得到的滤渣含有的金属有______种。
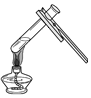
(4)步骤③操作I中用到的玻璃容器为_______(填仪器名称)。
(5)已知步骤④中发生分解反应,写出有二氧化碳气体产生的化学方程式______。
【答案】Zn2+、Fe2+、Cu2+ 置换反应 3 烧杯和漏斗和玻璃棒 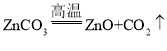
【解析】
(1)工业氧化锌中含有氧化锌、氧化亚铁、氧化铜。氧化锌和硫酸反应生成硫酸锌和水,氧化亚铁和硫酸反应生成硫酸亚铁和水,氧化铜和硫酸反应生成硫酸铜和水。则浸出液中含有锌离子、亚铁离子和铜离子。故答案为:Zn2+、Fe2+、Cu2+;
(2)锌和硫酸亚铁反应生成硫酸锌和铁,锌和硫酸铜反应生成硫酸锌和铜。两个反应都是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应。故答案为:置换反应;
(3)步骤②中有锌置换出来的金属铁、铜,以及过量的锌。所以步骤②得到的滤渣中含有3种金属。故答案为:3;
(4)步骤③中的操作Ⅰ,将固体和液体分离,是过滤操作。实验室进行过滤操作,常会使用漏斗、烧杯、玻璃棒三种玻璃仪器。故答案为:烧杯和漏斗和玻璃棒;
(5)根据质量守恒定律可知,反应分解出二氧化碳气体,则反应物中也应该含有碳元素。所以是碳酸锌受热分解为氧化锌和二氧化碳。故答案为: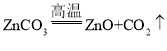 。
。

练习册系列答案
相关题目