题目内容
已知碳酸氢钠不稳定,受热易分解(2NaHCO3
Na2CO3+H2O+CO2↑),现取Na2CO3和NaHCO3的混合物40g,加热到质量不再改变为止,剩余固体质量为27.6g,下列说法正确的是( )
| ||
| A、反应后生成CO2的质量为12.4g |
| B、反应后CO2和H2O的质量比为22:9 |
| C、原混合物中NaHCO3的质量为16.8g |
| D、原混合物中Na2CO3的质量分数为16% |
分析:根据“碳酸氢钠和碳酸钠的混合物40g”当加热的时候只有碳酸氢钠会分解生成二氧化碳,碳酸钠不变,依据质量守恒定律可以求出固体减少的质量,即二氧化碳和水的质量,根据方程式可以求出碳酸氢钠的质量,根据方程式中水和二氧化碳的比可以求出反应后CO2和H2O的质量比;
解答:解:根据质量守恒定律可知,反应后生成的二氧化碳和水的质量之和为12.4g;故A错误;
设原混合物中碳酸氢钠的质量为X,
2NaHCO3
Na2CO3+H2O+CO2↑ 固体减少的质量
168 106 18 44 62
x 12.4g
=
x=33.6g,故C错误;
依据方程式中的比例关系可以求得二氧化碳和水的质量比是:44:18=22:9,故B正确;
碳酸钠的质量是:40-33.6g,碳酸钠的质量分数为:
×100%=16%,故D正确;
故选BD.
设原混合物中碳酸氢钠的质量为X,
2NaHCO3
| ||
168 106 18 44 62
x 12.4g
| 168 |
| x |
| 62 |
| 12.4 |
x=33.6g,故C错误;
依据方程式中的比例关系可以求得二氧化碳和水的质量比是:44:18=22:9,故B正确;
碳酸钠的质量是:40-33.6g,碳酸钠的质量分数为:
| 6.4 |
| 40 |
故选BD.
点评:本题是以选择题的形式考查了混合物和化学方程式结合在一起对物质进行计算,比较复杂,要求学生认真审题,很容易误选A,要注意有液体水的生成.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
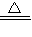 Na2CO3+CO2↑+H2O.现取Na2CO3和NaHCO3的混合物10g,加热到质量不再改变为止,剩余固体质量为6.9g.下列说法正确的是( )
Na2CO3+CO2↑+H2O.现取Na2CO3和NaHCO3的混合物10g,加热到质量不再改变为止,剩余固体质量为6.9g.下列说法正确的是( )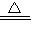 Na2CO3+CO2↑+H2O.现取Na2CO3和NaHCO3的混合物10g,加热到质量不再改变为止,剩余固体质量为6.9g.下列说法正确的是( )
Na2CO3+CO2↑+H2O.现取Na2CO3和NaHCO3的混合物10g,加热到质量不再改变为止,剩余固体质量为6.9g.下列说法正确的是( ) Na2CO3+H2O+CO2↑),现取Na2CO3和NaHCO3的混合物40g,加热到质量不再改变为止,剩余固体质量为27.6g,下列说法正确的是( )
Na2CO3+H2O+CO2↑),现取Na2CO3和NaHCO3的混合物40g,加热到质量不再改变为止,剩余固体质量为27.6g,下列说法正确的是( )