��Ŀ����
����Ŀ������Fe��Fe2O3�Ĺ����������ͬѧΪ�˷����������Fe��Fe2O3�ĺ������������ͼʵ�鷽���� 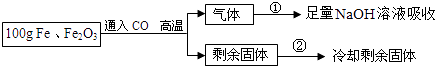
��ʵ�����ݡ�ʵ�鹲��¼������ʵ�����ݣ�
�ڢ��飬��ȫ���������NaOH��Һ����������66g��
�ڢ��飬��ȫ��Ӧ����ȴ�����ʣ����������ΪWg��
����ʵ����Ƽ��й����ݽ��з�������㣮
��1�����ݵڢٽ����ݣ�CO��Fe2O3 �� ��Ӧ����CO2g��
��2���������Fe2O3������Ϊ���٣�
��3���ڢ�������W��g��
���𰸡�
��1��66
��2���⣺�����������Fe2O3������Ϊx����Ӧ���ɵ�����������y
Fe2O3+3CO | 2Fe+ | 3CO2 |
160 | 112 | 132 |
x | y | 66g |
![]() ��
�� ![]()
��� x=80g y=56g
�𣺻������Fe2O3������Ϊ80g��
��3��76
���������⣺��1������Fe��Fe2O3ͨ��CO �ᷢ��Fe2O3+3CO ![]() 2Fe+3CO2�ķ�Ӧ���������ɵ������Ƕ�����̼�����ڶ�����̼����NaOH��Һ��Ӧ����̼���ƺ�ˮ������NaOH��Һ�����ؾ��Ƕ�����̼����������Ϊ66g����3���ڢ����ݼ������ɵ�����ԭ����������֮�ͣ�Ϊ56g+��100g��80g��=76g��
2Fe+3CO2�ķ�Ӧ���������ɵ������Ƕ�����̼�����ڶ�����̼����NaOH��Һ��Ӧ����̼���ƺ�ˮ������NaOH��Һ�����ؾ��Ƕ�����̼����������Ϊ66g����3���ڢ����ݼ������ɵ�����ԭ����������֮�ͣ�Ϊ56g+��100g��80g��=76g��
�𰸣���1��66�� ��2�� ��3��76��
�����㾫����ͨ��������ø��ݻ�ѧ��Ӧ����ʽ�ļ��㣬���ո����ʼ�������=ϵ������Է�������֮�ȼ����Խ����⣮

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�