题目内容
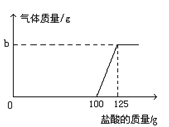
【题目】在实验室中,化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取试剂19.8g放入锥形瓶中,加入30.2g的水,充分振荡,再向锥形瓶中依次滴加25g盐酸充分反应。测得部分数据与图像如下。请根据有关信息回答问题。
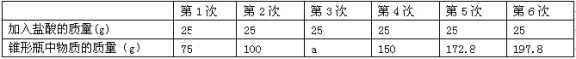
(1)a的数值为
(2)b的数值为
(3)计算该试剂中氢氧化钙的质量分数(写出计算过程,结
果保留一位小数)。
【答案】(1) 125 (2) 2.2 (3) 74.7%
【解析】
试题分析:(1) 根据第四次的质量比第二次的增加50g,故a=125
(2) 生成的二氧化碳的质量为:150g+25g-172.8g=2.2g
(3)设需要碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
![]()
解得:x=5g
试剂中氢氧化钙的质量分数![]()
答:试剂中氢氧化钙的质量分数为74.7%

练习册系列答案
相关题目