题目内容
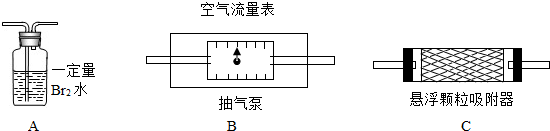
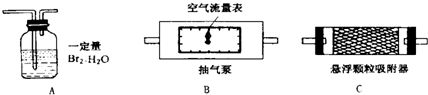
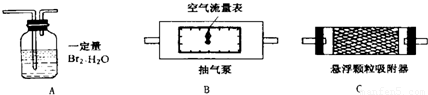
二氧化硫、悬浮颗粒物、氮的氧化物是主要的大气污染物.我国政府十分重视环境保护工作,大气污染物的含量均由环保部门严密地监控着.目前空气中SO2的含量是根据SO2和Br2(溴)、H2O的定量反应“Br2+2H2O+SO2=H2SO4+2HBr”来测定的.利用这一反应在电解池中进行时产生的电流变化,可以准确测出空气中SO2的含量.某校化学课外活动小组为同时测定校园附近空气中SO2和悬浮颗粒物的含量,设计、采用了如图所示的装置: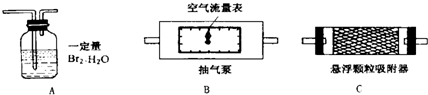
其中装置B中的空气流量表可以准确测定流经气泵的空气质量.问:
(1)测定悬浮颗粒和SO2含量时,以上装置连接的顺序为(填序号)
(2)为保证SO2测定结果的准确性,测定进行时当发现装置A中出现
(3)测定空气中悬浮颗粒含量时,除要测出进入装置的空气质量外,还要测出(填序号):
①实验前B的质量 ②实验后B的质量 ③实验前C的质量 ④实验后C的质量
(4)城市空气中SO2的主要来源是(填序号)
①火山爆发 ②植物的光合作用 ③煤和石油的燃烧 ④化学实验室的排放.

其中装置B中的空气流量表可以准确测定流经气泵的空气质量.问:
(1)测定悬浮颗粒和SO2含量时,以上装置连接的顺序为(填序号)
B、C、A
B、C、A
.(2)为保证SO2测定结果的准确性,测定进行时当发现装置A中出现
橙黄色变无色
橙黄色变无色
的现象时,应立即关闭抽气泵.(3)测定空气中悬浮颗粒含量时,除要测出进入装置的空气质量外,还要测出(填序号):
③④
③④
.①实验前B的质量 ②实验后B的质量 ③实验前C的质量 ④实验后C的质量
(4)城市空气中SO2的主要来源是(填序号)
③
③
①火山爆发 ②植物的光合作用 ③煤和石油的燃烧 ④化学实验室的排放.
分析:本题是一道测定校园附近空气中SO2和悬浮颗粒物的含量的实验探究题,首先要分析清楚各装置的作用;然后依据题干提供的信息进行分析,要分别测定可吸入颗粒物和二氧化硫含量时,抽气泵可在被测量物前面,可吸入颗粒的含量与悬浮颗粒吸附器的质量变化有关;二氧化硫能使溴水褪色,二氧化硫主要来自含硫化石燃料的燃烧.
解答:解:(1)要测定可吸入颗粒物和二氧化硫含量,需使可吸入颗粒物和二氧化硫流经抽气泵,再依据AC装置的质量变化分析二者含量;
故答案为:B、C、A;
(2)溴水是橙黄色,二氧化硫能使溴水褪色,当颜色恰好褪去时,二氧化硫恰好反应;
故答案为:橙黄色变无色;
(3)可吸入颗粒的含量与悬浮颗粒吸附器的质量变化有关,所以还需要测量实验前后C的质量变化;
故答案为:③④;
(4)城市空气中二氧化硫主要来自含硫化石燃料的燃烧;
故答案为:③.
故答案为:B、C、A;
(2)溴水是橙黄色,二氧化硫能使溴水褪色,当颜色恰好褪去时,二氧化硫恰好反应;
故答案为:橙黄色变无色;
(3)可吸入颗粒的含量与悬浮颗粒吸附器的质量变化有关,所以还需要测量实验前后C的质量变化;
故答案为:③④;
(4)城市空气中二氧化硫主要来自含硫化石燃料的燃烧;
故答案为:③.
点评:本题以实验探究的方式考查了空气污染的有关知识,可以依据题干提供的信息,结合已有知识分析解答;同时渗透环保意识,要保护环境,防止大气污染.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目