题目内容
【题目】某白色固体混合物可能含有Na2CO3、 KOH、MgCl2、CaC12中的一种或几种。为了确定该混合物的成份,化学兴趣小组同学进行了如图所示实验:
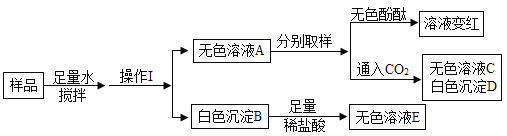
(1)在固体样品中加入足量水搅拌后的操作Ⅰ是__________。
(2)往白色沉淀B中加入足量稀盐酸,沉淀全部溶解且无气泡产生,则反应的化学方程式为_______。
(3)取无色溶液A少量于试管中,通入CO2,得到无色溶液C和白色沉淀D,该步骤发生的化学反应方程式为______。
(4)原白色固体中一定含有的物质是_________。
【答案】过滤 Mg(OH)2+2HCl=MgCl2+2H2O 2KOH+CO2=K2CO3+H2O,K2CO3+CaCl2=CaCO3↓+2KCl KOH、MgCl2、CaCl2
【解析】
根据实验可知:加入足量的水,溶解之后,得到白色沉淀B和无色滤液A,氢氧化钾与氯化镁反应生成氢氧化镁和氯化钾,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,可以推测白色沉淀是两物质反应产生的不溶于水的物质,可能是氢氧化镁或者是碳酸钙;向白色沉淀B中加入足量的稀盐酸,沉淀全部溶解且无气泡产生,氢氧化镁与盐酸反应生成氯化镁和水,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,说明该白色沉淀B为氢氧化镁,不是碳酸钙;将无色溶液A分别取样滴入酚酞,溶液变红,说明溶液呈碱性,可能是氢氧化钾或者是碳酸钠使得酚酞变红,另取样通入二氧化碳,得到白色沉淀D和无色溶液C;可知该白色沉淀D为碳酸钙;因此溶液中存在CaCl2,则无色溶液A中没有Na2CO3;经过以上分析可得:白色固体混合物含有KOH、MgCl2、CaCl2;而没有Na2CO3;代入验证可得推导正确。
(1)在固体样品中加入足量水搅拌后,将固体和液体进行分离,因此操作Ⅰ是过滤;
(2)往白色沉淀B中加入足量稀盐酸,沉淀全部溶解且无气泡产生,说明没有碳酸钙,因此只是氢氧化镁与盐酸的反应,其化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O;
(3)取无色溶液A少量于试管中,通入CO2,得到无色溶液C和白色沉淀D,该步骤发生反应原理如下:先是二氧化碳与氢氧化钾反应生成碳酸钾和水,再碳酸钾与氯化钙反应生成碳酸钙沉淀,发生的化学反应方程式为:2KOH+CO2=K2CO3+H2O,K2CO3+CaCl2=CaCO3↓+2KCl;
(4)由分析可得:原白色固体中含有的物质是KOH、MgCl2、CaCl2。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案