题目内容
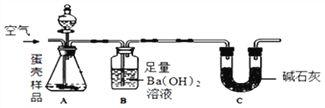
【题目】下列图象能正确反映所对应叙述关系的是

A. 图甲表示一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系
B. 图乙表示t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体,溶质质量分数与加入量的关系
C. 图丙表示一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系
D. 图丁表示向硫酸和硫酸铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系
【答案】D
【解析】A、由于木炭还原氧化铜生成金属铜,因此达到一定温度时随着反应的进行固体的质量会越来越少,但不会减到为零,错误;B、由于是向饱和的硝酸钾溶液中加入硝酸钾晶体,因此硝酸钾晶体不会再被溶解,溶液中溶质的质量分数也不会随着硝酸钾晶体的加入而增大,错误;C、由于向硫酸溶液中每加入65份质量的金属锌只得到2份质量的氢气,因此在反应的过程中溶液的质量是逐渐增大的,当一定量的稀硫酸全部参与反应以后,溶液的质量就不再发生变化,错误;D、由于向硫酸和硫酸铜混合溶液中加入氢氧化钠溶液时。由于氢氧化钠和硫酸铜反应会生成能够溶解于硫酸的氢氧化铜,也就是在酸性环境中氢氧化钠不能和硫酸铜反应,因此只有等酸被完全消耗后才能生成氢氧化铜,所以不能开始就有沉淀,正确。故选D。

【题目】某研究小组为探究影响铁制品锈蚀及快慢的因素,设计了如下两个实验,依据实验回答下列问题。(已知:氯化钙可作干燥剂;稀氨水呈碱性)
实验一:探究铁制品生锈的条件
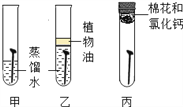
实验二:探究影响铁制品锈蚀快慢的因素(稀氨水和稀醋酸的质量分数相同)
| 实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 | |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 | |
出现铁锈 所需时间 | 1天 未见锈蚀 | 5分钟 | 1天 未见锈蚀 | 1分钟 |
(1)实验一的乙中植物油的作用是____。
(2)由实验一探究铁制品生锈结果可知铁锈中含有的元素是____。
(3)实验②和④可探究_____因素对铁制品锈蚀快慢的因素;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是_____(填实验序号)。
(4)由实验二表中实验现象得出的结论是______ 。
【题目】实验室有一瓶保存不当的试剂(如图所示),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小华等几位同学很感兴趣,决定对其成分进行探究.
(提出问题)这瓶试剂溶质是什么?
(1)(交流研讨)根据受损标签的情况判断,这瓶试剂不可能是___(填字母序号)
A.酸B.碱C.盐
(2)(查阅资料)①初中化学常见含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3 . ②Na2CO3、NaHCO3溶液都呈碱性.NaCl溶液呈中性.③室温(20℃)时,4种物质的溶解度的数据如下.
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(得出结论)小华根据试剂瓶上标注和上表溶解度数据判断,这瓶试剂不可能是______
(3)(猜想与实验)①可能是________溶液; ②可能是NaOH溶液; ③可能是NaCl溶液.
(4)小亮用pH试纸测得该溶液的pH=11,他判断该溶液不可能是________
(5)小强为了确定该溶液的成分,进行了如下实验.
操作步骤 | 实验现象 | 结论及化学方程式 |
步骤一:取样品于试管中,滴加足量________ | 产生大量的气泡 | 猜想①正确. 步骤一发生反应的化学方程式是________ |
步骤二:把产生的气体,通入___ | ________ |
(6)(质疑)小华则不同意小强的观点,认为溶液中有Na2CO3还可能有NaOH.请你帮助他完成以下探究方案
探究步骤 | 预计现象 | 结论 |
步骤一:取样品于试管中,向其中滴加足量的________溶液,充分反应后过滤 | 产生白色沉淀 | 溶液中既含Na2CO3,又含有NaOH |
步骤二:向上述滤液中滴加酚酞试液 | 酚酞试液变___色 |
(7)(反思)为了防止标签发生破损,我们在倾倒溶液时应注意________.(写1点)
(8)(含量计算)小明想测定样品中NaOH的质量分数,称取上述10g样品溶液,逐滴加入7.3%稀盐酸至过量,(不考虑先生成碳酸氢钠的影响)测得生成气体质量与所加稀盐酸质量关系如图2所示:请回答下列问题:
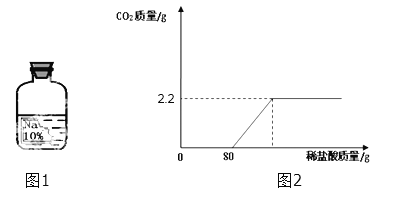
①当稀盐酸加到20g时,样品溶液中的溶质是________
②求样品溶液中NaOH的质量分数_______________.