题目内容
【题目】小明同学探究质量守恒定律:他查阅资料,得知①铁和硫酸铜溶液反应生成铜和硫酸亚铁,②碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳。
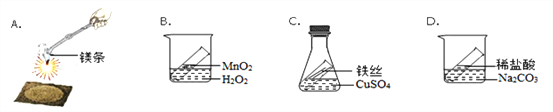
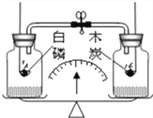
(1)图A中,镁带在空气中燃烧的化学方程式为_______________;镁带完全燃烧后,小明称得生成固体的质量大于反应前镁带的质量,请分析造成反应前后固体质量不相等的原因_________ 。
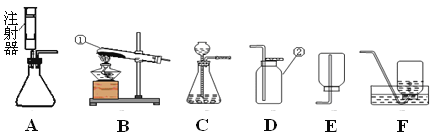
(2)某同学用图D研究质量守恒定律,完全反应后发现指针偏_______(填“左”或“右”),如何改进实验装置_______________。
(3)写出C装置中发生反应的化学方程式_________________________。
(4)根据上述分析, 装置________能用来验证质量守恒定律
【答案】 2Mg+O2![]() 2MgO 反应物中有氧气 右 改用密闭容器 Fe+CuSO4==FeSO4+Cu C
2MgO 反应物中有氧气 右 改用密闭容器 Fe+CuSO4==FeSO4+Cu C
【解析】(1)、镁和氧气在点燃的条件下生成氧化镁;根据质量守恒定律,镁燃烧后质量增加,实际上增加了参加反应的氧气的质量;(2)、根据实验在开放的环境中进行解答;(3)、根据铁和硫酸铜反应生成铜和硫酸亚铁解答;(4)、根据实验应在密闭环境中进行解答。解:(1)、镁和氧气在点燃的条件下生成氧化镁,故答案为:2Mg+O2点燃2MgO;根据质量守恒定律,镁燃烧后质量增加,造成反应前后固体质量不相等的原因是:反应物中有氧气;(2)、碳酸钠与稀盐酸反应,生成氯化钠、水和二氧化碳。二氧化碳气体逸出,所以完全反应后发现指针偏右;应将烧杯改用密闭容器;(3)、铁和硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为:Fe+ CuSO4 == Cu + FeSO4;(4)、根据上述分析, 装置C密封,能用来验证质量守恒定律。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加.
【知识回放】
金属活动性顺序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au,请你在横线上填写对应金属的元素符号.
【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是 .
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
实验 | 试管1 | 试管2 | 试管3 |
实验 操作 |
|
|
|
实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 |
【结论与解释】
(1)小聪得到的结论是猜想 正确.
(2)实验前用砂纸打磨金属片的目的是 .
【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式 .