题目内容
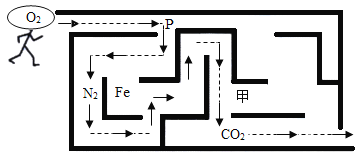
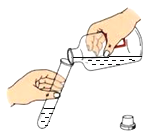
【题目】为测定空气里氧气的含量,甲、乙、丙三个同学用如下图所示的装置分别进行了实验探究。
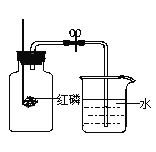
(1)甲同学:点燃红磷立即伸入瓶中并塞紧瓶塞。看到的现象是在集气瓶内产生_______。待红磷燃烧停止并冷却后,打开止水夹,发现水进入集气瓶,是因为瓶中压强_________(填变大、变小、不变)。甲同学实验结果小于1/5。可能的原因是(写两条)_____________ 、_________________。
(2)乙同学:用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水,其原因__________。
(3)丙同学:向集气瓶中加入少量的 ______ ,然后完成乙同学的实验,得到了与甲同学相同的实验结果。
(4)此实验还可推知反应后剩余气体的两点性质是____________、_____________。
【答案】大量白烟 变大 红磷量不足 装置漏气 生成CO2气体,瓶中压强几乎不变 氢氧化钠溶液 难溶于水 不可燃、不助燃(合理即可)
【解析】
(1)甲同学:点燃红磷立即伸入瓶中并塞紧瓶塞。看到的现象是在集气瓶内产生大量白烟;待红磷燃烧停止并冷却后,打开止水夹,发现水进入集气瓶,是因为红磷燃烧消耗瓶内的气体,瓶中压强变小;甲同学实验结果小于1/5。可能的原因是红磷量不足、装置漏气等;
(2)碳在空气中燃烧生成CO2气体,瓶中压强几乎不变。用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水,是因为反应生成CO2气体,瓶中压强几乎不变;
(3)氢氧化钠能与二氧化碳反应生成碳酸钠和水,氢氧化钠溶液能吸收二氧化碳,丙同学要想得到正确的实验结论必须消耗掉生成的二氧化碳气体,故可选择氢氧化钠溶液吸收二氧化碳;
(4)此实验中红磷是过量的,过量的红磷没有被完全消耗,进入集气瓶中的水只有1/5,还可推知反应后剩余气体的性质是难溶于水,不可燃、不助燃。

 名校课堂系列答案
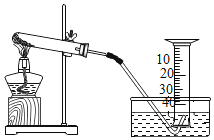
名校课堂系列答案【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用如图装置完成表中实验:
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50 mL O2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是________。
(2)表中所列3种催化剂的催化效果最佳的是_____。
(3)写出KClO3分解的符号表达式:______________________。
(4)由实验1和实验4可知,KCl__(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集50 mL O2,所需时间明显少于171 s,解释原因:_______。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50 mL O2所需时间外,还可以测量相同时间内____________。