题目内容
化学课外活动小组的同学对某炼铁厂生产的生铁(杂质不与酸反应)进行组成分析.其实验数据如下表,请计算生铁的纯度.(精确到0.1%)
| 实验步骤 | 数据 |
| (1)称取生铁样品放入烧杯中 | 14.5g |
| (2)加入足量15%的盐酸 | 200.0g |
| (3)称量反应后烧杯中物质总质量 | 214.0g |
解:生成氢气的质量为:200g+14.5g-214g=0.5g,
设参与反应的Fe的质量为x,
Fe+2HCl═FeCl2+H2↑
56 2
x 0.5g
 =
=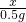
解之得x=14g,
生铁的纯度为: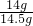 ×100%≈96.6%.
×100%≈96.6%.
答:生铁的纯度为96.6%.
分析:因为反应中生成的气体逸出,故根据质量守恒定律,生成氢气的质量=反应后烧杯中物质总质量-加入盐酸质量-生铁样品质量;然后根据铁与稀盐酸反应的化学方程式和生成的氢气质量,列出比例式,即可计算出参与反应的Fe的质量,然后根据质量分数公式计算即可.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.
设参与反应的Fe的质量为x,
Fe+2HCl═FeCl2+H2↑
56 2
x 0.5g
 =
=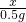
解之得x=14g,
生铁的纯度为:
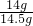 ×100%≈96.6%.
×100%≈96.6%.答:生铁的纯度为96.6%.
分析:因为反应中生成的气体逸出,故根据质量守恒定律,生成氢气的质量=反应后烧杯中物质总质量-加入盐酸质量-生铁样品质量;然后根据铁与稀盐酸反应的化学方程式和生成的氢气质量,列出比例式,即可计算出参与反应的Fe的质量,然后根据质量分数公式计算即可.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
相关题目
某学校化学课外活动小组的同学,取刚降到地面的雨水样,用PH计(测PH的仪器)每隔同分钟测一定PH,其数据如下表示:
隔几分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 |
| PH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 |
(1)所降雨水 (填“是”或“不是”)酸雨,在测定的时间内雨水的酸性
(填“增强”或“减弱”)
(2)经调查,这一区有一个硫酸厂(生产过程产生的氧化物)和一个电镀厂,这些工厂使
用的燃料主要是煤(煤中含有硫元素)。另外,这—地区的生活燃料主要也是煤,还有液化石油气。试分析造成这一地区酸雨的主要原因是什么?你认为应采取什么措施?
某学校化学课外活动小组的同学,取刚降到地面的雨水样,用pH计(测pH的仪器)每隔同分钟测一定pH,其数据如下表示:隔几分钟测一次pH,其数据如下表所示:
(1)所降雨水______(填“是”或“不是”)酸雨,在测定的时间内雨水的酸性______
(填“增强”或“减弱”).
(2)经调查,这一区有一个硫酸厂(生产过程产生的氧化物)和一个电镀厂,这些工厂使用的燃料主要是煤(煤中含有硫元素).另外,这一地区的生活燃料主要也是煤,还有液化石油气.试分析造成这一地区酸雨的主要原因是什么?你认为应采取什么措施?
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 |
(填“增强”或“减弱”).
(2)经调查,这一区有一个硫酸厂(生产过程产生的氧化物)和一个电镀厂,这些工厂使用的燃料主要是煤(煤中含有硫元素).另外,这一地区的生活燃料主要也是煤,还有液化石油气.试分析造成这一地区酸雨的主要原因是什么?你认为应采取什么措施?
(2002?长沙)某学校化学课外活动小组的同学,取刚降到地面的雨水样,用pH计(测pH的仪器)每隔同分钟测一定pH,其数据如下表示:隔几分钟测一次pH,其数据如下表所示:
(1)所降雨水______(填“是”或“不是”)酸雨,在测定的时间内雨水的酸性______
(填“增强”或“减弱”).
(2)经调查,这一区有一个硫酸厂(生产过程产生的氧化物)和一个电镀厂,这些工厂使用的燃料主要是煤(煤中含有硫元素).另外,这一地区的生活燃料主要也是煤,还有液化石油气.试分析造成这一地区酸雨的主要原因是什么?你认为应采取什么措施?
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 |
(填“增强”或“减弱”).
(2)经调查,这一区有一个硫酸厂(生产过程产生的氧化物)和一个电镀厂,这些工厂使用的燃料主要是煤(煤中含有硫元素).另外,这一地区的生活燃料主要也是煤,还有液化石油气.试分析造成这一地区酸雨的主要原因是什么?你认为应采取什么措施?