��Ŀ����
�ҹ���ѧ���о���̼���⣨Mo2C �����ؽ�ԭ����ɵĸ�Ч����ϵ��ʹˮú���е�CO��H2O��120���·�����Ӧ����Ӧ��ģ����ͼ��ʾ��

��1����Ӧ��ģ���У��������_____��Ԫ�أ���_____�ֵ��ʷ���
��2���÷�Ӧ�����й��ɴ����ĸ�ԭ��_____����С���û�С����仯��
��3����ԭ�Ӷ�_____���CO����H2O���������������á�
��4����Ӧ�Ļ�ѧ����ʽΪ_____��
��5��������Ӧ�У�һ�������ı����_____��������ţ�
��Ԫ������ ��ԭ������ �۷�������
 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д����й��ɺ��ܽ���ȫ��ȷ��һ����
A���Գ��Ӻͼ������ʶ | B�������ʶ����ʶ |
����Ca��OH��2��Һ��ȥNaOH��������Na2CO3 ������ʯ�Ҽ�������狀������ ���÷���ˮ����Ӳˮ����ˮ | ��ú¯�Ϸ�һ��ˮ����Ԥ��CO�ж� ��Һ����й©ʱӦ�����رշ��Ų�����ͨ�� ����ˮ����ԭ���ǽ��Ϳ�ȼ����Ż�� |
C������������;����ʶ | D���Ը�������� |
�������̿����ǿ�����Կ������������� �����������п�ȼ�Կ��������� ����ϡ������ͨ��ʱ������ɫ�Ĺ���Ƴɸ��ֵ��Դ | ���ܸı䷴Ӧ���ʵ�����һ���Ǵ��� ��������Ӧһ�������������������ķ�Ӧ �ۺϽ��������Ĵ�����ǿ�Ⱥ�Ӳ�ȸ��ߡ�����ʴ���ܸ��� |
A. A B. B C. C D. D
���жԻ�ѧ֪ʶ�Ĺ��ɲ���ȷ����
A�����ʵ����� | B�����ʵķ��� |
�������Ƶ��������������� | CH3COOH������ |
C�����ʵ��������� | D�����ʵļ��� |
�ɱ������� | �����봿��ë���ϡ���ȼ�� |
ͬѧ���ڰ���ʦ����ʵ����ʱ������ʯ��ˮ�Լ�ƿƿ�ں�ƿ����Χ��һЩ��ɫ��ĩ��Ϊ��Ū�����ɫ��ĩ�ijɷּ��γ�ԭ�����ǽ���������̽����
�����ϣ��ٱ��Ǽ������ʳ���ʱ���ܼ�����
�ڷ�̪�Լ���������Һ���ɫ��ʯ��ˮ��Һ�Լ���
OH�� | Cl�� | CO32�� | NO3�� | |
Ca2+ | | �� | �� | �� |
��1����ɫ��ĩ�ɷֵIJ���ͳ���
��ɫ��ĩ�ijɷ� | �γɵ�ԭ�� |
������CaCO3 | ��Ӧ�Ļ�ѧ����ʽΪ��_____ |
������Ca��OH��2 | ������½ϸߣ����ʵ��ܽ�Ƚ��ͻ��ܼ�������ʯ��ˮ�е����ʽᾧ���� |
��������˼����ͬѧ����Ϊ��ɫ��ĩ�������Ƕ��ߵĻ���
��2�����ʵ�飺��ͬѧȡ��ɫ��ĩװ���Թ��У���������ˮ�������а�ɫ���岻�ܽ⣬�������ó���ĩ��һ����CaCO3��������Ϊ��ͬѧ�Ľ��۲����ܣ�������_____��Ϊ�˵ó������ܵĽ��ۣ����ǽ���������ʵ�飬���������ʵ�鱨�棺
ʵ�鲽�� | ���ܹ۲쵽������ | ���� |
ȡ�����Թ��е��ϴ���ҹ���μ�1��2����ɫ��̪��Һ | _____ | _____ |
�������Թ��еIJ��������м���ϡ���� | _____ | ��ɫ��ĩ_____�����С����ޡ���CaCO3 |
������ʵ���֪��ɫ��ĩ�ijɷ��ǣ�_____�� |
��3��ʵ��Ӧ�ã���ʢ��̼��Ʒ�ĩ���Թ��м���������ϡ���ᣬ��ȫ��Ӧ���ռ���4.4g������̼���壬�Լ��㷴Ӧ���ĵ�̼��Ƶ�����_____��


 R��CO2
R��CO2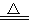 RO��H2O
RO��H2O

 B. ��������ϡ����Դ
B. ��������ϡ����Դ
 D. ̫���ܷ���
D. ̫���ܷ���