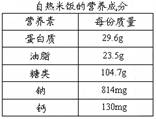
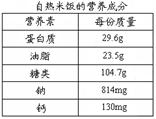
题目内容
锂电池是生活中一种性能优越的电池,它放电时发生的化学反应为Li+MnO2=LiMnO2,求3.5g Li (锂)参加反应所消耗的MnO2的质量.
解:设消耗的二氧化锰质量为x
MnO2+Li=LiMnO2
87 7
x 3.5g
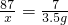
x=43.5g
答:3.5gLi(锂)参加反应所消耗的MnO2的质量为43.5g.
分析:根据反应的化学方程式,可求得反应中Li与MnO2的质量关系,利用这一质量关系,由参加反应的Li的质量可计算反应消耗二氧化锰的质量.
点评:根据化学方程式可反映各物质的质量关系,由反应中已知物质的质量可计算反应中其它物质的质量.
MnO2+Li=LiMnO2
87 7
x 3.5g
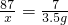
x=43.5g
答:3.5gLi(锂)参加反应所消耗的MnO2的质量为43.5g.
分析:根据反应的化学方程式,可求得反应中Li与MnO2的质量关系,利用这一质量关系,由参加反应的Li的质量可计算反应消耗二氧化锰的质量.
点评:根据化学方程式可反映各物质的质量关系,由反应中已知物质的质量可计算反应中其它物质的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目