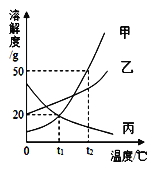
题目内容
【题目】自来水厂常用氯气来杀菌消毒,某班学生对氯气的制取、性质、用途进行如下探究:
【查阅资料】氯气(C12)是无色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成盐酸和次氯酸(HClO)
【探究一】制取氯气
(1)实验室常用二氧化锰固体和浓盐酸加热制取氯气,同时还生成氯化锰(其中锰元素显+2价)和水,请写出该反应的化学方程式:______。
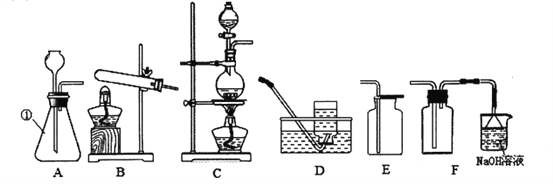
(2)下图中仪器①的名称是_____,实验室制取氯气应选择的发生装置和最佳收集装置是__(填序号)。
【探究二】氯气的性质
(1)小明用下图一装置探究氯气的漂白性:
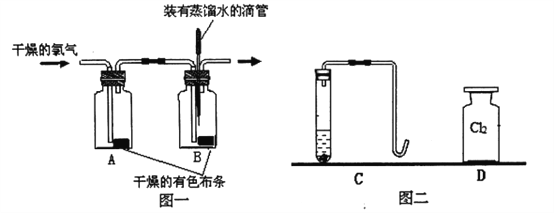
实验步骤:I.将滴管内的蒸馏水滴到B瓶中的干燥有色布条上,布条没有褪色;
II.通入干燥的C12,发现A瓶中的布条没有褪色,而B瓶中的布条褪色。
①通过上述实验,小明能得到的结论是____。
②小颖根据查阅的资料信息,补充做了一个实验:____(写出实验步骤和现象),从而得出“次氯酸具有漂白性”的结论。
③小明同学认为,上图一实验装置中有一个明显的缺陷,该装置的不足之处是____。
(2)小星用上图二装置探究氯气的助燃性:
实验步骤:I.用锌粒和稀硫酸在C装置中制取氢气,请写出该反应的化学方程式:____;
II.先____,然后再点燃氢气,产生淡蓝色火焰;
III.将燃着的氢气导管缓缓伸到装满氯气的集气瓶D中,观察到氢气继续燃烧并产生
苍白色火焰。请写出该反应的化学方程式:____。
实验反思:①小星发现氢气在氯气中燃烧时,集气瓶D瓶口上方有大量白雾,你认为产生白雾的可能原因是____。
②通过氢气能在氯气中燃烧的实验,你对燃烧有什么新的认识?____。
【探究三】氯气的用途
氯气不仅用于消毒,还是重要的化工原料,利用氯气可以制取盐酸、“84”消毒液、漂白粉等。
(1)已知“84”消毒液的生产原理是:C12+2NaOH=NaCl+NaClO(次氯酸钠)+H20,若向lOOkg16%的氢氧化钠溶液中通入适当的氯气恰好完全反应,理论上可得到“84”消毒液的质量是 __。
(2)请仿照“84”消毒液的生产原理,写出用氯气和石灰乳制取漂白粉的化学方程式:____。
【答案】 MnO2+4HCl(浓)![]() MnCl 2+Cl2↑+2H2O 锥形瓶 CF 干燥的氯气没有漂白性,湿润的氯气具有漂白性 将少量盐酸滴到有色布条上,布条不褪色 缺少尾气处理装置 Zn + H2SO4 = ZnSO4 + H2↑ 检验氢气的纯度 H2 + Cl2
MnCl 2+Cl2↑+2H2O 锥形瓶 CF 干燥的氯气没有漂白性,湿润的氯气具有漂白性 将少量盐酸滴到有色布条上,布条不褪色 缺少尾气处理装置 Zn + H2SO4 = ZnSO4 + H2↑ 检验氢气的纯度 H2 + Cl2![]() 2HCl 燃烧生成的氯化氢气体与空气中的水蒸气接触,形成的盐酸小液滴 燃烧不一定需要氧气参加(或其他合理答案) 114.2Kg 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2HCl 燃烧生成的氯化氢气体与空气中的水蒸气接触,形成的盐酸小液滴 燃烧不一定需要氧气参加(或其他合理答案) 114.2Kg 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】【探究一】(1) 二氧化锰固体和浓盐酸加热生成氯气、氯化锰和水,化学方程式为:MnO2+4HCl(浓)![]() MnCl 2+Cl2↑+2H2O;
MnCl 2+Cl2↑+2H2O;
(2)仪器①是锥形瓶,实验室制取氯气是固+液加热型,应选择C发生装置,由于氯气有毒,密度比空气大,可溶于水生成盐酸和次氯酸(HClO),最佳收集装置是F;
【探究二】 (1)① 通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有褪色,因此甲同学得出结论:干燥的氯气没有漂白性,潮湿的氯气有漂白性;
②由于氯气溶于水生成盐酸和次氯酸(HClO),得出“次氯酸具有漂白性”的结论,要排除盐酸的可能,将少量盐酸滴到有色布条上,布条不褪色;
③由于氯气有毒,应作尾气处理;
(2)锌粒和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn + H2SO4 = ZnSO4 + H2↑;氢气不纯会爆炸,点燃前应检验氢气的纯度;氢气在氯气中燃烧生成氯化氢气体,化学方程式:H2 + Cl2![]() 2HCl;
2HCl;
①燃烧生成的氯化氢气体与空气中的水蒸气接触,形成的盐酸小液滴,看上去就是白雾;
②通过氢气能在氯气中燃烧的实验,可得燃烧不一定需要氧气参加;
【探究三】(1)设恰好反应吸收的氯气为x
C12+2NaOH=NaCl+NaClO+H2O
71 80
x l00kg×16%
![]()
x=14.2kg
由质量守恒定律可知,理论上可得到“84”消毒液的质量是100kg+14.2kg=114.2kg;
(2)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。我校兴趣小组的同学为此开展了以下探究活动:
【提出问题1】鸡蛋白中主要的营养成分是______ ;
【查阅资料】
a、CaCO3灼烧分解生成氧化钙和一种无毒的氧化物。
b、蛋壳中的其它成分不参加反应。
c、NaHCO3+HCl= NaCl + H2O +CO2↑,Ba(OH)2+CO2=BaCO3↓+H2O,
d、已知仪器a装有10%的稀盐酸,其他成分均不与HCl反应,装置内试剂均足量。
【提出问题2】蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定。请你参与他们的探究。
【设计方案】他们分别称取12.0g蛋壳设计了以下不同的实验方案:
小华的方案:
称取12.0g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g。则:减少的质量是______ (填化学式)的质量,经计算得蛋壳中的CaCO3的质量分数为______ 。
(3)小明的方案:小明设计了如下图所示的实验装置。
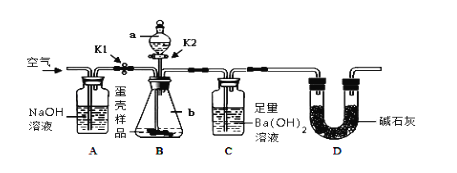
【实验步骤】
①按上图连接好装置后,并______ ;
②向B装置中加入蛋壳样品后,先通入空气一会儿;
③接下来的实验操作是______ ,直到______ 为止(填实验现象);
④再通入空气一会儿,至装置C中不再产生沉淀为止;
⑤将装置C中的固液混合物过滤、洗涤、烘干后称量其质量;
⑥重复上述实验。
【实验数据】重复实验,3次数据记录如下:
实验次数 | 实验1 | 实验2 | 实验3 |
装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
【实验分析及数据处理】
①上述数据能否用托盘天平称量______ 。(填“能”或“不能”)
②若无A装置,直接通入空气,则测定结果将______ 。(填“偏大”、“偏小”或“不变”)D装置的作用是___
③实验重复3次的目的是______ 。
④请利用3次实验数据的平均值,计算该蛋壳中的CaCO3质量分数______ 。
【实验反思】
下列各项措施中,能提高小明测定准确度的是______ (填序号)。
Ⅰ.在装置A、B之间增加盛有浓硫酸的洗气瓶
Ⅱ.缓缓滴加稀盐酸
Ⅲ.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶
IV.直接称量装置C反应前后的质量