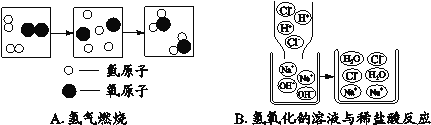
题目内容
【题目】(5分)硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用。取8.5%的过氧化氢溶液40 g倒入小烧杯中,向其中加入15%的硫酸铜溶液6.6 g,使过氧化氢完全分解。
计算:(1)过氧化氢溶液中溶质的质量为______g。
(2)产生氧气的质量(写出计算过程)。
(3)反应后所得硫酸铜溶液中溶质的质量分数(写出计算过程)。
【答案】(1)3.4;(2)[解]设过氧化氢完全分解生成氧气的质量为x。
2H2O2 CuSO42H2O + O2↑
68 32
3.4 g x
![]() x=1.6g
x=1.6g
答:略。
(3)硫酸铜的质量:6.6 g × 15% =0. 99 g
所得溶液的质量:40 g + 6.6 g -1.6 g=45 g
所得硫酸铜溶液中溶质的质量分数=![]() ×100% =2.2%
×100% =2.2%
答:略。
【解析】
试题分析:(1)已知过氧化氢溶液的质量和溶质质量分数,即可求得其溶质质量;(2)利用化学方程式和过氧化氢的质量即可求得生成氧气的质量;(3)利用原硫酸铜溶液的质量和其溶质质量分数即可求得硫酸铜的质量,依据质量守恒定律可以求得放出氧气后的溶液质量,利用溶质质量分数的计算公式即可作答。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】(7分)化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
【查得资料】(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
(2)饱和碳酸氢钠溶液不吸收二氧化碳。
【设计实验】小组同学设计了下图所示装置(图中夹持仪器略去) 测定牙膏样品中碳酸钙的含量。
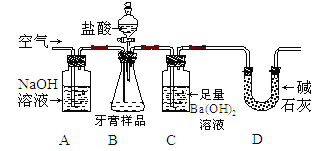
依据图示回答下列问题:
(1)该装置中氢氧化钠溶液的作用是 。
(2)C中观察到有沉淀产生,反应的化学方程式为__________。
(3)实验过程中需持续缓缓通入空气,其作用有 。
【解释与结论】实验测得如下数据:
实验次数 | 样品质量(g) | 所用盐酸质量(g) | 所得沉淀质量(g) |
第一次 | 8.00 | 50 | 1.95 |
第二次 | 8.00 | 50 | 1.98 |
第三次 | 8.00 | 50 | 1.96 |
欲计算样品中碳酸钙的含量,应选择的数据是 。
【反思与评价】
(1)有人认为不必测定C中沉淀的质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_________________。
(2)反思实验过程,小刚同学提出应采取必要措施,提高测定准确度。他提出的下列各项措施中,不
能提高测定准确度的是__________(填字母序号)。
a.在加入盐酸之前,排净装置内的CO2气体
b.放慢滴加盐酸的速度
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置