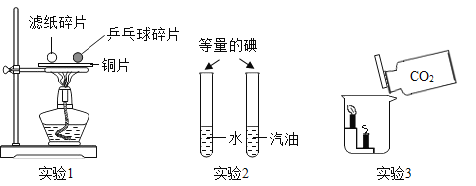
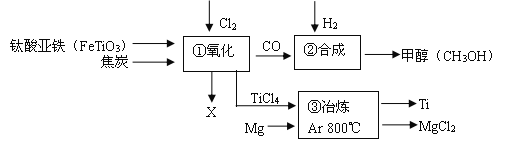
题目内容
【题目】高铁酸钾(K2FeO4)是一种新型多功能水处理剂。如图是制取K2FeO4同时得到副产品K2SO4的流程,根据图示回答下列问题。
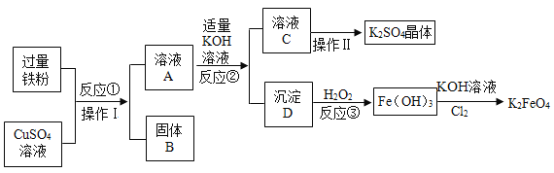
(1)固体B中含有的物质是_____________________。
(2)操作I的名称是_____________________;进行操作Ⅱ时,当有______________时停止加热;操作I和操作Ⅱ使用的同一种玻璃仪器是_____________________。
(3)反应②发生的是复分解反应,请写出该反应的化学方程式_____________________。
(4)指出K2SO4晶体的一种用途_____________________。
【答案】铁、铜 过滤 较多晶体析出 玻璃棒 ![]() 作钾肥
作钾肥
【解析】
(1)过量的铁粉与硫酸铜溶液反应,生成固体铜和硫酸亚铁,所以固体B中含有生成的铜和过量的铁。
(2)操作I可以得到固体B和溶液A,使固体和液体分离,操作I是过滤;通过操作Ⅱ可以得到硫酸钾晶体,所以操作Ⅱ蒸发硫酸钾溶液,蒸发时,当有较多晶体析出时停止加热;操作I和操作Ⅱ使用的同一种玻璃仪器是玻璃棒。
(3)反应②是硫酸亚铁与氢氧化钾发生复分解反应,该反应的化学方程式为![]() 。
。
(4)K2SO4晶体中含有钾元素,所以可以用作钾肥。

 阅读快车系列答案
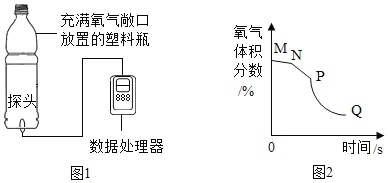
阅读快车系列答案【题目】有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。小柯利用如图装置测定疏通剂中铝的质量分数。
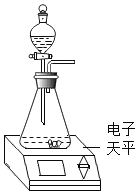
Ⅰ.取样品20g,倒入容积为200ml的锥形瓶中,然后在分液漏斗中加入水,置于电子天平上测出总质量m1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2。
Ⅲ.实验数据如下表:
反应前总质量m1 | 反应后总质量m2 |
371.84g | 371.24g |
回答下列问题:
(1)配平化学方程式:2Al+2NaOH+2H2O![]() ______NaAlO2+3H2↑
______NaAlO2+3H2↑
(2)根据化学方程式计算样品中铝的质量分数。______
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有______。
A向锥形瓶中倒入样品时,撒出了部分粉末
B在反应过程中有水蒸气逸出
C没有等装置中氢气全部排尽就称量