题目内容
【题目】(6分)下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
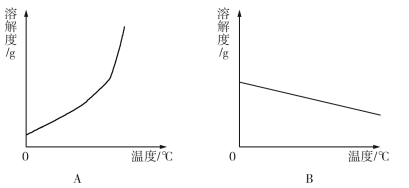
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是 。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙 甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 。
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”)。
【答案】(1)A ; (2)D ; (3)9.1 g (漏写单位不得分) ; (4)< ;有关(5)降温结晶,过滤 ; (6)偏小。
【解析】
试题分析:(1)氢氧化钠的溶解度随温度的升高而增加,所以能表示氢氧化钠溶解度曲线的是图A;(2)氢氧化钙的溶解度随温度的升高而降低,所以要使氢氧化钙的不饱和溶液变为饱和溶液,可采取的措施为:加入溶质氢氧化钙或蒸发水分或升高温度;加入碳化钙时,氧化钙和水反应生成氢氧化钙,溶剂的质量减少,并且温度升高,所以也可以使不饱和的氢氧化钙溶液变为饱和溶液,故答案为D;(3)20℃时,氢氧化钠的溶解度是91g ,即 100g最多溶解91g氢氧化钠,则蒸发10g水,析出氢氧化钠的质量为9.1g;(4)氢氧化钙的溶解度随温度的升高而降低,氧化钙溶于水生成氢氧化钙的反应放出大量的热,所以向20℃时Ca(OH)2的饱和溶液(甲溶液)中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数是:乙<甲;(5)氢氧化钙的溶解度随温度的升高而降低,氢氧化钠的溶解度随温度的升高而增大,并且氢氧化钙的溶解度很小,所以可用降温,冷却热饱和溶液的方法稀氢氧化钠结晶析出,然后过滤即可得到较为纯净的氢氧化钠;(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的溶质质量分数减小,碱性减弱,pH值偏小。

 全优点练单元计划系列答案
全优点练单元计划系列答案