题目内容
【题目】锌和氯化锌的固体混合物10克,放入90.2克的盐酸中,充分搅拌反应,在固体混合物全部消失后,得到100克溶液。如果盐酸也恰好全部反应,试求:
(有关反应的化学方程式为:Zn+2HCl =ZnCl2 +H2↑)
(1)根据质量守恒定律,生成的氢气质量为_______克。
(2)反应前,固体混合物中锌的质量为多少?(请写出计算过程)__________
(3)反应后,所得氯化锌溶液的质量百分数是_______。
【答案】0.2 6.5g 17.1%
【解析】
(1)根据质量守恒定律可知道恰好完全反应放出氢气的质量=10g+90.2g-100g=0.2g;
(2)设:参加反应的锌的质量为x,生成氯化锌的质量为y。
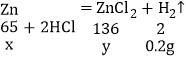
![]() x=6.5g;
x=6.5g;
![]() y=13.6g;
y=13.6g;
原混合物中氯化锌的质量=10g-6.5g=3.5g;
反应后硫酸锌溶液中溶质的质量分数=![]() 。
。
答:(1)根据质量守恒定律,生成的氢气质量为0.2克。
(2)反应前,固体混合物中锌的质量为6.5g;
(3)反应后,所得氯化锌溶液的质量百分数是17.1%。

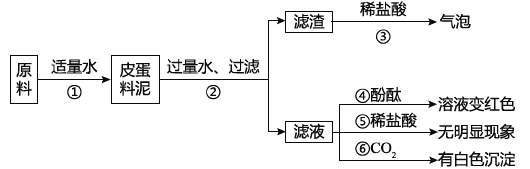
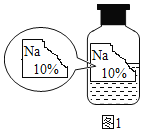
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,进行了如下的究活动:
(查阅资料)
Ⅰ.BaCl2溶液呈中性;
Ⅱ.常温下,有关物质的相关信息如表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度(g/100g水) | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是 NaHCO3因为_____。
(进行实验)
①取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是_____。
②另取样品又进行了如下实验,实验过程如图:
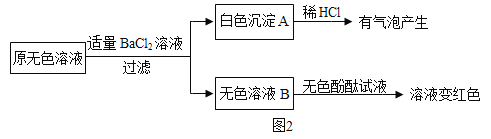
生成白色沉淀A的化学方程式_____。通过实验可以判断样品原无色溶液中含有的溶质有_____。
下列试剂能替代上述实验中无色酚酞试液检验的是_____。(填序号)
Ⅰ.FeCl3 Ⅱ.HNO3 Ⅲ.CO2 Ⅳ.CuO
(获得结论)实验完成后,最终得到的结论:原瓶中的溶质是_____,且已变质;变质的原因是(用化学方程式表示)_____。
【题目】甲、乙、丙三种物质只通过一步反应,不能实现如图所示的转化关系的是( )
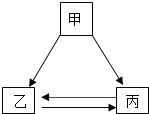
甲 | 乙 | 丙 | |
A | C | CO | CO2 |
B | CuO | Cu | Cu(NO3)2 |
C | CaCO3 | CO2 | H2O |
D | H2SO4 | H2 | H2O |
A. AB. BC. CD. D
【题目】甲、乙、丙三种物质只通过一步反应,不能实现如图所示的转化关系的是( )
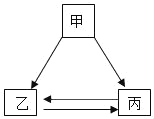
甲 | 乙 | 丙 | |
A | C | CO | CO2 |
B | CuO | Cu | Cu(NO3)2 |
C | CaCO3 | CO2 | H2O |
D | H2SO4 | H2 | H2O |
A. AB. BC. CD. D