题目内容
在一个小烧杯中加入少量硫酸铜溶液,把一小包铁粉放入一定量的硫酸铜溶液中,放置很长一段时间后,烧杯中仍有少量固体.请你对固体的成分进行探究.
(1)猜想:固体的成分可能是________________.
(2)实验:请设计实验验证你的猜想.(说明实验过程、现象和结论)
________________.
(3)若剩余固体是铁和铜的混合物,应该如何将二者区分开来?
答案:
解析:
解析:
|
答案:(1)铜(或:铁和铜的混合物) (2)向所得固体中加入适量的稀盐酸,固体不溶解,且无气泡产生,则原固体是铜(或:向固体中加入过量的稀盐酸,固体部分溶解,且有气泡产生,则原固体是铁和铜的混合物) (3)用磁铁吸引 讲析:(1)铁能与硫酸铜溶液反应得到单质铜.对于“把一小包铁粉放入一定量的硫酸铜溶液中”,反应后所得固体成分的推测,应该从两个方面进行分析:①若是铁粉不足或铁粉与硫酸铜恰好完全反应,则所得固体只有金属铜;②如果铁粉有剩余,则所得固体应该是铁和铜的混合物.(2)对所得固体成分猜想的验证,应该根据铁的化学性质来设计实验.但是有一点,对于药品试剂的选择不应该再选择硫酸铜溶液,这是因为如果反应后所得固体是铁和铜的混合物,加入硫酸铜溶液后,不容易判断是否有铜生成,因此最好的试剂应该是稀硫酸或稀盐酸.(3)区分铁与其他金属最简便的方法就是用磁铁吸引. 点评:本题是教材实验的拓展与延伸,从其特点来看是一道开放性试题,注重考查学生的发散思维能力.解决上述类型的题目,最关键之处是掌握金属的化学性质,根据问题的实际把握分析的角度. |

练习册系列答案
相关题目


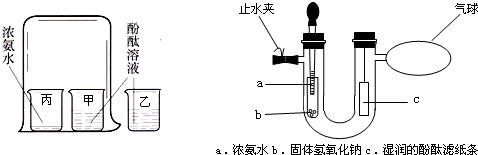
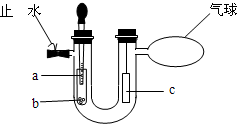 18、某同学在学完《分子和原子》后,对教材中的图3-8所示的实验进行了如图所示的改进:
18、某同学在学完《分子和原子》后,对教材中的图3-8所示的实验进行了如图所示的改进: 同学们在做实验时,要大胆设计创新,也要及时发现实验中的异常.
同学们在做实验时,要大胆设计创新,也要及时发现实验中的异常.