题目内容
取一定量的CuO粉末与0.5L某稀硫酸充分反应后,将一根50g的铁棒(过量)插入上述溶液中至铁棒的质量不再改变时,取出铁棒干燥,称重为50.24g.并收集到氢气0.02g,则原来CuO粉末的质量为下列的
- A.2.4g
- B.6.4g
- C.8g
- D.1.92g
C
分析:根据酸与金属氧化物的反应以及在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来进行分析,在进行计算时,要根据产生氢气的质量求算出与酸反应的铁的质量,然后根据金属铁增重的量求算出硫酸铜的质量,即可求出氧化铜的质量.
解答:氧化铜能与连锁反应生成硫酸铜和水,生成的硫酸铜能与铁反应生成硫酸亚铁和铜,生成的铜附着在铁的表面,铁能与硫酸反应生成氢气,设生成0.02g氢气需要铁的质量为x则有
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.02g
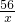 =
=
x=0.56g
则与硫酸铜反应的铁的质量为50g-0.56g=49.44g,反应后铁棒的质量为50.24g,说明铁与硫酸铜反应时增重的质量为50.24g-49.44g=0.8g,设硫酸铜的质量为y,根据反应的化学方程式则有
Fe+CuSO4═FeSO4+Cu△m
56 160 64 8
y 0.8g
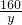 =
=
y=16g
设氧化铜的质量为z.则有
CuO+H2SO4═CuSO4+H2O
80 160
z 16g
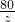 =
=
z=8g
故选C.
点评:本题考查了金属活动性顺序的应用以及根据化学方程式的计算,完成此题,可以依据已有的知识结合题干提供的信息进行.
分析:根据酸与金属氧化物的反应以及在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来进行分析,在进行计算时,要根据产生氢气的质量求算出与酸反应的铁的质量,然后根据金属铁增重的量求算出硫酸铜的质量,即可求出氧化铜的质量.
解答:氧化铜能与连锁反应生成硫酸铜和水,生成的硫酸铜能与铁反应生成硫酸亚铁和铜,生成的铜附着在铁的表面,铁能与硫酸反应生成氢气,设生成0.02g氢气需要铁的质量为x则有
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.02g
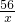 =
=
x=0.56g
则与硫酸铜反应的铁的质量为50g-0.56g=49.44g,反应后铁棒的质量为50.24g,说明铁与硫酸铜反应时增重的质量为50.24g-49.44g=0.8g,设硫酸铜的质量为y,根据反应的化学方程式则有
Fe+CuSO4═FeSO4+Cu△m
56 160 64 8
y 0.8g
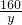 =
=
y=16g
设氧化铜的质量为z.则有
CuO+H2SO4═CuSO4+H2O
80 160
z 16g
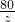 =
=
z=8g
故选C.
点评:本题考查了金属活动性顺序的应用以及根据化学方程式的计算,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目