题目内容
(1)某硫酸厂生产出的硫酸产品为98%硫酸和发烟硫酸(H2SO4和SO3的化合物,其中SO3的质量分数为20%).如果98%硫酸可表示为SO3?a H2O,20%发烟硫酸可表示为H2O?b SO3,则a、b的值(用分数表示)分别为:a=______,b=______.(2)大棚种植蔬菜在冬季需补充CO2.某同学在自家大棚内设计了补充CO2的方法:将工业废H2SO4用水稀释后,盛放在______(填容器)内,悬挂在高处,每天向桶内加适量的碳酸氢铵即可.
①将容器悬挂在高处的原因是______.
②这种补充CO2的方法的设计非常合理,除原料易得外,该反应产物之一硫酸铵在农村又可用作______.
③写出该反应的化学方程式:______.
(3)密度为1.45g?cm-3的溶液中,逐滴滴入BaCl2溶液,直到沉淀恰好完全为止,已知生成HCl的溶液的质量与原BaCl2溶液质量相同,则原H2SO4溶液中的质量分数为______.(用分数表示)
【答案】分析:(1)根据题意,98%硫酸可表示为SO3?a H2O,通过整理即为:H2SO4?(a-1)H2O,由该溶液中H2SO4(溶质)与H2O(溶剂)的质量关系可得:98:18(a-1)=98%:(1-98%),解出a即可;同理,20%发烟硫酸可表示为H2O?bSO3,通过整理即为:H2SO4?(b-1)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98:80(b-1)=(1-20%):20%,解出b即可;
(2)根据硫酸的性质分析盛放的容器,根据二氧化碳的密度分析将容器悬挂在高处的原因,根据硫酸铵的组成元素分析在农村中可用作的肥料,根据反应物、生成物及反应条件写出反应的方程式;
(3)根据题意可知,生成HCl的溶液的质量=氯化钡溶液的质量+硫酸溶液的质量-硫酸钡的质量,根据题意:生成HCl的溶液的质量恰好等于原BaCl2溶液的质量,由此可知:硫酸溶液的质量=硫酸钡的质量;依据硫酸与氯化钡反应的化学方程式,假设原硫酸溶液的质量,由反应中硫酸与硫酸钡的质量关系,求出硫酸溶液中溶质的质量,再由溶液中溶质质量分数计算式求出硫酸溶液中溶质质量分数.
解答:解:(1)由题意可知,98%硫酸可表示为SO3?aH2O,通过整理即为:H2SO4?(a-1)H2O,由于该溶液中H2SO4(溶质)与H2O(溶剂)的质量关系可得:98:18(a-1)=98%:(1-98%),解得:a=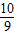 ;同理,20%发烟硫酸可表示为H2O?bSO3,通过整理即为:H2SO4?(b-1)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98:80(b-1)=(1-20%):20%,解得:b=
;同理,20%发烟硫酸可表示为H2O?bSO3,通过整理即为:H2SO4?(b-1)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98:80(b-1)=(1-20%):20%,解得:b=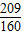 ;
;
(2)由于硫酸能与一些金属反应,常盛放于塑料桶内,由于二氧化碳的密度比空气的大,应将塑料桶悬挂在高处,硫酸铵在农村中可用作氮肥,硫酸与碳酸氢铵反应的方程式是:H2SO4+2NH4HCO3=(NH4)2SO4+2H2O+2CO2↑;
(3)由题意可知,硫酸溶液的质量=硫酸钡的质量,设硫酸钡的质量为233g,则硫酸溶液的质量为233g,再设硫酸溶液中溶质的质量是x
BaCl2+H2SO4═BaSO4↓+2HCl
98 233
x 233g
 =
=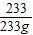 x=98g
x=98g
所以滴入的硫酸溶液中溶质的质量分数是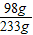 ×100%=42.1%.
×100%=42.1%.
故答为:(1)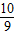 ,
,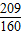 ;(2)塑料桶,①二氧化碳的密度比空气的大;②氮肥,③H2SO4+2NH4HCO3=(NH4)2SO4+2H2O+2CO2↑;(3)42.1%.
;(2)塑料桶,①二氧化碳的密度比空气的大;②氮肥,③H2SO4+2NH4HCO3=(NH4)2SO4+2H2O+2CO2↑;(3)42.1%.
点评:本题的综合性很强,涉及的知识点较多,有一定的难度,特别是计算时,恰当的对数据进行处理,计算起来才能较为简便.
(2)根据硫酸的性质分析盛放的容器,根据二氧化碳的密度分析将容器悬挂在高处的原因,根据硫酸铵的组成元素分析在农村中可用作的肥料,根据反应物、生成物及反应条件写出反应的方程式;
(3)根据题意可知,生成HCl的溶液的质量=氯化钡溶液的质量+硫酸溶液的质量-硫酸钡的质量,根据题意:生成HCl的溶液的质量恰好等于原BaCl2溶液的质量,由此可知:硫酸溶液的质量=硫酸钡的质量;依据硫酸与氯化钡反应的化学方程式,假设原硫酸溶液的质量,由反应中硫酸与硫酸钡的质量关系,求出硫酸溶液中溶质的质量,再由溶液中溶质质量分数计算式求出硫酸溶液中溶质质量分数.
解答:解:(1)由题意可知,98%硫酸可表示为SO3?aH2O,通过整理即为:H2SO4?(a-1)H2O,由于该溶液中H2SO4(溶质)与H2O(溶剂)的质量关系可得:98:18(a-1)=98%:(1-98%),解得:a=
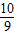 ;同理,20%发烟硫酸可表示为H2O?bSO3,通过整理即为:H2SO4?(b-1)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98:80(b-1)=(1-20%):20%,解得:b=
;同理,20%发烟硫酸可表示为H2O?bSO3,通过整理即为:H2SO4?(b-1)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98:80(b-1)=(1-20%):20%,解得:b=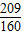 ;
;(2)由于硫酸能与一些金属反应,常盛放于塑料桶内,由于二氧化碳的密度比空气的大,应将塑料桶悬挂在高处,硫酸铵在农村中可用作氮肥,硫酸与碳酸氢铵反应的方程式是:H2SO4+2NH4HCO3=(NH4)2SO4+2H2O+2CO2↑;
(3)由题意可知,硫酸溶液的质量=硫酸钡的质量,设硫酸钡的质量为233g,则硫酸溶液的质量为233g,再设硫酸溶液中溶质的质量是x
BaCl2+H2SO4═BaSO4↓+2HCl
98 233
x 233g
 =
=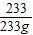 x=98g
x=98g所以滴入的硫酸溶液中溶质的质量分数是
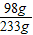 ×100%=42.1%.
×100%=42.1%.故答为:(1)
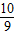 ,
,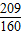 ;(2)塑料桶,①二氧化碳的密度比空气的大;②氮肥,③H2SO4+2NH4HCO3=(NH4)2SO4+2H2O+2CO2↑;(3)42.1%.
;(2)塑料桶,①二氧化碳的密度比空气的大;②氮肥,③H2SO4+2NH4HCO3=(NH4)2SO4+2H2O+2CO2↑;(3)42.1%.点评:本题的综合性很强,涉及的知识点较多,有一定的难度,特别是计算时,恰当的对数据进行处理,计算起来才能较为简便.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目