题目内容
在托盘天平左盘的烧杯里盛有一定质量的稀硫酸,在天平右盘加砝码使天平平衡.然后向烧杯中加锌片,充分反应后取出剩余的1.65克锌片(假设溶液无损失),再向天平右盘添11克砝码,又达到平衡.则最初放入烧杯中锌片的质量是________克(取整数).
13
分析:根据“向烧杯中加锌片,充分反应后取出剩余的1.65克锌片,再向天平右盘添11克砝码,又达到平衡”,说明了充分反应取出剩余锌片后,溶液质量增加了11g;根据反应的化学方程式,利用溶液增加的质量计算出参加反应锌的质量,该质量与剩余锌的质量和即最初放入烧杯中锌片的质量.
解答:设参加反应的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑ 反应后溶液质量增加
65 2 65-2=63
x 11g
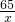 =
= x=11.35g
x=11.35g
则最初放入烧杯中锌片的质量=11.35g+1.65g=13g
故答案为:13.
点评:本题采取反应后溶液的差量法进行计算,可使计算过程简便许多,差量法是解决类似问题的简便方法.
分析:根据“向烧杯中加锌片,充分反应后取出剩余的1.65克锌片,再向天平右盘添11克砝码,又达到平衡”,说明了充分反应取出剩余锌片后,溶液质量增加了11g;根据反应的化学方程式,利用溶液增加的质量计算出参加反应锌的质量,该质量与剩余锌的质量和即最初放入烧杯中锌片的质量.
解答:设参加反应的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑ 反应后溶液质量增加
65 2 65-2=63
x 11g
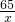 =
= x=11.35g
x=11.35g则最初放入烧杯中锌片的质量=11.35g+1.65g=13g
故答案为:13.
点评:本题采取反应后溶液的差量法进行计算,可使计算过程简便许多,差量法是解决类似问题的简便方法.

练习册系列答案
相关题目