题目内容
【题目】某课外活动小组为测定某不纯锌粒中含锌的质量分数,取来了一些锌粒样品,并取稀硫酸800g,平均分成4份,将四份不同质量的样品加入到四份稀硫酸中,进行实验(杂质不与稀硫酸反应),结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品是质量/g | 6.5 | 13 | 19.5 | 26 |
生成H2的质量/g | 0.16 | 0.32 | 0.40 | m |
(1)上表中m的数值是________;
(2)试计算这种锌粒样品中锌的质量分数____________(写出计算过程).
【答案】0.4080%
【解析】
取稀硫酸800g,平均分成4份进行实验,每次实验使用稀硫酸200g;根据实验结果数据表,6.5g不纯锌粒完全反应可以生成氢气0.16g,若19.5g不纯锌粒完全反应生成氢气质量=0.16g×3=0.48g,而实验中仅放出0.40g氢气,说明此时锌粒没有完全反应,没有完全反应是由于稀硫酸不足;在选择实验数据进行计算时,要选择锌粒完全反应的实验,否则会因锌粒未能完全反应而计算结果偏小。
解:(1)根据实验结果数据表,6.5g不纯锌粒完全反应可以生成氢气0.16g,若19.5g不纯锌粒完全反应生成氢气质量=0.16g×3=0.48g,而实验中仅放出0.40g氢气,说明此时锌粒没有完全反应,没有完全反应是由于稀硫酸不足,所以第四次实验稀硫酸不足,m为0.40;(2)设第1次实验中样品中的锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.16g
![]()
x=5.2g
样品中锌质量分数![]() ×100%=80%;
×100%=80%;
答:(1)上表中m的数值是0.40;(2)样品中锌质量分数80%。

 名师指导期末冲刺卷系列答案
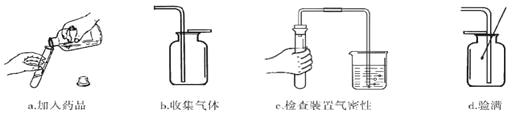
名师指导期末冲刺卷系列答案【题目】我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法。
(1)实验室制取气体时,确定发生装置需要考虑的两种因素有 (填序号)。
A.反应物的状态 | B.气体的密度 |
C.反应的条件 | D.气体的溶解性 |
(2)某实验室的仪器柜里有如下仪器:

仪器①的名称是 。实验室用大理石和稀盐酸制备并收集二氧化碳时,不可能选择的仪器是 (填序号)。
(3)老师提出用碳酸钠粉末与稀盐酸制取二氧化碳,其反应的化学方程式为
。为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是 (填序号),该装置的最大优点是 。