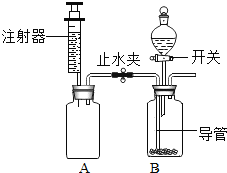
��Ŀ����
����Ŀ��ij��ѧ��ȤС��ѧϰ�ᡢ������ʺ�ͨ��ʵ��Լ�Ļ�ѧ���ʽ�����֤���ܽᣬ��ͼ��ʾ����֪��CaCl2��Һ�����ԣ�CaCl2+Na2CO3=CaCO3��+2NaCl����

��1����ͬѧ����̪��Һ����Ca��OH��2��Һ�У��۲쵽��Һ��죬�ó����ۣ�Ca��OH��2��Һ�� ������ԡ��������ԡ������ԡ�����
��2����ͬѧ��������ϡ������뵽��ͬѧ������Һ�У��۲쵽��ɫ��ȥ����ʱ������Һ�к��е������� �����ָʾ�����⣩��
��3����ͬѧ���ݷ�Ӧ�۵ó����ۣ�ʵ���Ҵ�ż���Һʱ�� ��
��4����ͬѧ��Na2CO3��Һ����Ca��OH��2��Һ�У���ַ�Ӧ������ͬѧ������Һ��ϣ����ú��֣��ϲ�Ϊ��ɫ������Һ���ײ��а�ɫ���������ϲ���Һ��һ�����е������� �����ָʾ�����⣩�����ܺ��е������� ��Ϊ��֤���ܺ��е����ʣ�Ӧ�ò����ʵ������� ��
���𰸡���1�����ԣ���2��CaCl2��HCl����3���ܷⱣ�棻��4��NaCl��CaCl2��ȡ�����ϲ���Һ���Թ��У����Թ��ڵμ�̼������Һ������а�ɫ�������ɣ�˵�������Ȼ��ƣ����û�а�ɫ�������ɣ�˵���������Ȼ��ƣ�
����������1����̪��Һ������ɫ������̪��Һ����Ca��OH��2��Һ�У��۲쵽��Һ��죬˵��Ca��OH��2��Һ�ʼ��ԣ�
��2���������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ�����Է�Ӧ����Һ�е����ʺ����Ȼ��ƣ���Ϊ������������������л������Ȼ��⣻
��3�����ڼ�������ж�����̼��Ӧ�����ʣ�����Ҫ�ܷⱣ�棻
��4��Na2CO3��Һ����Ca��OH��2��Һ������̼��Ƴ������������ƣ�������ͬѧ������Һ���ʱ�����������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ������̼��Ʒ�Ӧ�����Ȼ��ơ�ˮ��������̼�������ϲ�Ϊ��ɫ������Һ��˵����Һ���Լ��ԣ����Բ����ܺ����������ƣ����Ȼ��ƿ��ܱ�̼���Ʒ�Ӧ����Ҳ����û����Ӧ������˴�Ӧ���ǣ��ϲ���Һ��һ�����е�������NaCl�����ָʾ�����⣩�����ܺ��е�������CaCl2�������Ȼ�����̼���Ʒ�Ӧ����̼��ư�ɫ���������Լ����Ƿ����Ȼ��ƣ�ȡ�����ϲ���Һ���Թ��У����Թ��ڵμ�̼������Һ������а�ɫ�������ɣ�˵�������Ȼ��ƣ����û�а�ɫ�������ɣ�˵���������Ȼ��ƣ�

 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д�