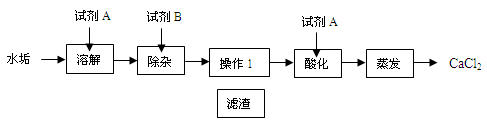
题目内容
除去下列物质中的杂质所用试剂或方法正确的是-------------------------------( )
| 选项 | 物质 | 少量杂质 | 所加试剂或方法 |
| A | CaCl2溶液 | HCl | 过量的CaC03 |
| B | H2 | 水蒸气 | 通过浓硫酸洗气 |
| C | H20 | 异味 | 加入明矾 |
| D | NaCl | Na2C03 | 加水溶解,加Ca(N03)2溶液、过滤、蒸发、结晶 |
B
试题分析:物质除杂时,可以根据物质性质,采用物理方法或化学方法,但要符合以下两个原则:①加入的试剂只能与杂质反应,不能与原物质反应,②原物质的质量不能减少且反应时不能带入新的杂质。除去氯化钙溶液中的少量盐酸,可加入过量的碳酸钙,过滤,A错误;浓硫酸具有吸水性可做干燥剂,可用于除去氢气中的水蒸气,干燥氢气,B正确;除去水中的异味,应用活性炭吸附,C错误;除去氯化钠中的碳酸钠,加入硝酸钙溶液,会产生新的杂质,硝酸钠,D错误。故选B。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
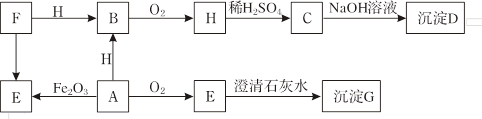
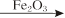 E的化学方程式 ;
E的化学方程式 ;