题目内容
【题目】请结合图示实验装置,回答下列问题。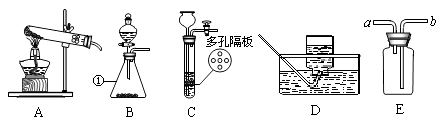
(1)写出标号①的仪器名称: 。
(2)用高锰酸钾制氧气选用的发生装置是(选填序号),反应的化学方程式为。
(3)若B装置中固体为二氧化锰,分液漏斗中加入可制氧气。若用D装置收集氧气,当导管口有气泡时才能将导管伸入集气瓶中。
(4)实验室可用B或C装置制二氧化碳,反应的化学方程式为 , C相对于B装置的优点有。若用E装置收集二氧化碳,气体应从端通入(选填“a”或“b”)。
【答案】
(1)锥形瓶
(2)A,2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
(3)双氧水(或过氧化氢溶液),连续均匀冒出
(4)CaCO3 + 2HCl = CaCl2 + H2O + CO2↑,控制反应的发生和停止,b
【解析】(1). 锥形瓶(2).加热固体制取气体应用发生装置A(3).高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰、氧气;反应方程式为: 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑(4).过氧化氢溶液在二氧化锰的作用下,常温下分解生成水和氧气,可用发生装置B,(5). 若用D装置收集氧气,当导管口有气泡连续均匀冒出时才能将导管伸入集气瓶中 开始收集氧气,开始从导管中排出的是装置中原有的空气,不能冒气泡就立即开始收集。(6). 实验室常用石灰石和盐酸制取二氧化碳,反应方程式为:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (7). 用C装置时,关闭弹簧夹,大试管内气体增多,压强变大,在压力的作用下,试管内液面下降,当液面下降到隔板下边时,固体反应物与液体分离,反应停止;反之,打开弹簧夹,反应开始。C相对于B装置的优点有控制反应的发生和停止(8). 二氧化碳的密度比空气的大,若用E装置收集二氧化碳,气体应从b端通入。
K2MnO4 + MnO2 + O2↑(4).过氧化氢溶液在二氧化锰的作用下,常温下分解生成水和氧气,可用发生装置B,(5). 若用D装置收集氧气,当导管口有气泡连续均匀冒出时才能将导管伸入集气瓶中 开始收集氧气,开始从导管中排出的是装置中原有的空气,不能冒气泡就立即开始收集。(6). 实验室常用石灰石和盐酸制取二氧化碳,反应方程式为:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (7). 用C装置时,关闭弹簧夹,大试管内气体增多,压强变大,在压力的作用下,试管内液面下降,当液面下降到隔板下边时,固体反应物与液体分离,反应停止;反之,打开弹簧夹,反应开始。C相对于B装置的优点有控制反应的发生和停止(8). 二氧化碳的密度比空气的大,若用E装置收集二氧化碳,气体应从b端通入。
根据氧气和二氧化碳的实验室制取方法分析,实验室制取氧气采用含氧化合物分解的方法,制取二氧化碳用石灰石与稀盐酸反应,由此写出反应方程式;根据固液常温反应若将药品分离,则可控制反应的发生和停止分析;根据二氧化碳密度比空气大,排空气法收集时,要长导管进入,短导管排空气分析。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案