题目内容
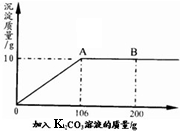
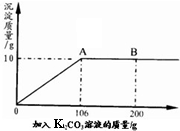
氯化钙钾石的化学式为KCl·xCaC12(x是CaCl2的系数)。它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液。某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。请回答下列问题:
(1)写出Na2CO3与CaCl2反应的化学方程式 。
(2)图中AB段表示的意义是 。
(3)18.55g氯化钙钾石样品中:
①CaCl2的质量是 g;
②KCl的质量是 g;
③钾元素的质量分数是 。
(4)所用N a2CO3溶液中溶质的质量分数是多少? (最后一问要求写出计算过程)
 |
(1) Na2CO3+CaCl2=CaCO3↓+2NaCl (1分)
(2) CaCl2已完全反应,且Na2CO3溶液过量 (1分)
(3) 11.1 7.45 21.0% (3分)
(4) 解:设106gNa2CO3溶液中Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl (1分)
106 100
x 10g
106:100=x:10g (1分)
x=10.6g
该所用Na2CO3溶液中Na2CO3的质量分数=10.6g/106g×100%=10% (1分)
答:所用Na2CO3溶液中Na2CO3的质量分数为10%

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
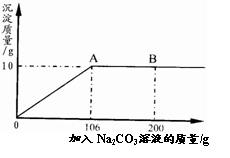
百分学生作业本题练王系列答案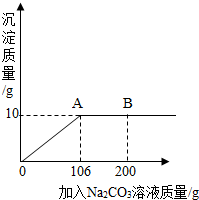 氯化钙钾石的化学式为KCl?xCaCl2(x是CaCl2的系数).它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如右图所示.请回答下列问题:
氯化钙钾石的化学式为KCl?xCaCl2(x是CaCl2的系数).它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如右图所示.请回答下列问题: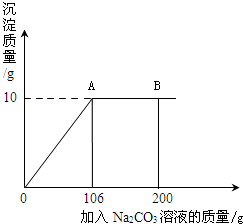 (2012?昌平区一模)氯化钙钾石的化学式为KCl?xCaCl2(x是CaCl2的系数).它是一种钾肥,溶于水后得到KCl和CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液210g,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如图所示.已知:Na2CO3+CaCl2═CaCO3↓+2NaCl,请计算:
(2012?昌平区一模)氯化钙钾石的化学式为KCl?xCaCl2(x是CaCl2的系数).它是一种钾肥,溶于水后得到KCl和CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液210g,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如图所示.已知:Na2CO3+CaCl2═CaCO3↓+2NaCl,请计算: