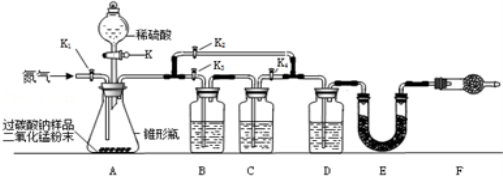
题目内容
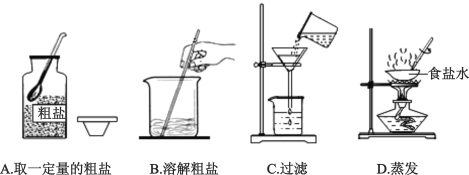
【题目】下列是初中化学中的一些重要实验,请回答:
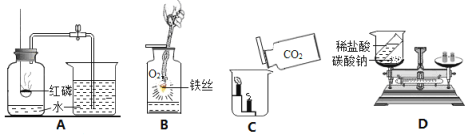
(1)实验A中红磷必须足量的原因是 ;
(2)实验B中发生反应的化学方程式为 ;
(3)实验C说明二氧化碳具有的化学性质是 ;
(4)实验D中反应后天平不平衡,该反应是否遵守质量守恒定律? (填“是”或“否”)。
【答案】(1)将瓶内的氧气完全消耗掉(2)3 Fe + 2 O2 点燃 Fe3O4(3)二氧化碳既不燃烧,也不支持燃烧,同时密度比空气大;(4)是
【解析】
试题分析:(1)红磷足量的目的是将瓶内的氧气完全消耗掉,使测量结果更精确;(2)铁与氧气在点燃条件下生成四氧化三铁;(3)下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳既不燃烧,也不支持燃烧,同时密度比空气大;(4)一切化学反应都遵守质量守恒定律,天平不平衡是因为装置不是密闭的体系,产生的气体逸出。

练习册系列答案
相关题目