题目内容
【题目】依据实验和溶解度曲线回答下列小题
20℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的硝酸钾固体,充分溶解。
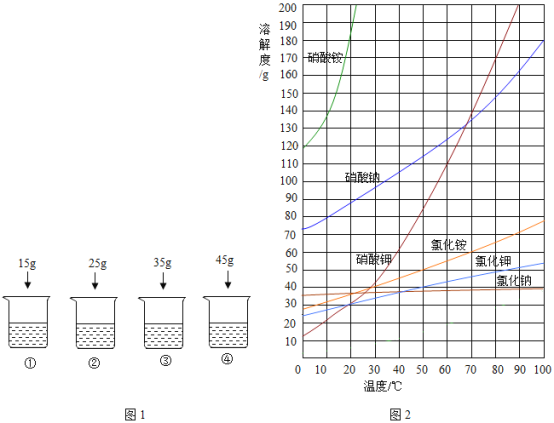
【1】上述烧杯中硝酸钾固体全部溶解的是
A. ①②B. ①②③C. ③④D. ④
【2】④中溶液的溶质质量分数约为
A. 45%B. 31%C. 30%D. 23%
【答案】
【1】A
【2】D
【解析】
【1】20℃时,硝酸钾的溶解度大约为30g,含义是20℃时,100g水中溶解硝酸钾30g,溶液达到饱和状态,①②加入的硝酸钾能全部溶解,③④加入的硝酸钾均有剩余,均有硝酸钾不能继续溶解,属于饱和溶液。故选A。
【2】20℃时,硝酸钾的溶解度大约为30g,含义是20℃时,100g水中最多能溶解硝酸钾30g;20℃时,向下列4只盛有100g水的烧杯中,④中最多只能溶解30g,溶液的溶质质量分数约为![]() 故选D。
故选D。
一定温度下饱和溶液的溶质分数=![]() 。
。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】请参与下列探究实验
步骤 | 实验操作 | 实验现象 | 结论或解释 |
(1) | (1)用玻棒分别蘸取95%的酒精、蒸馏水置于火焰上。 | 酒精_____,蒸馏水不燃烧。 | 结论:酒精是可燃物,水不是可燃物。 |
(2) | 在铁片两端放大小相同的硬纸片、乒乓球碎片,在铁片中间加热。 | 乒乓球碎片先燃烧、硬纸片后燃烧。 | 结论:乒乓球碎片的_____比硬纸片的低。 |
(3) | 在图中打开分液漏斗的旋塞 | ①溶液中产生_____; ②短蜡烛火焰_____填“先于”“后于”)长的熄灭。 | 现象②的原因是CO2 密度比空气大;_____。 |
(拓展)堆积的面粉不容易点燃,即使少量点燃也只是小火燃烧;如果把面粉撒向空中遇火星可能会发生爆炸。“小火燃烧”的原因是_____。发生爆炸的原因是:_____。
【题目】实验是科学探究的重要方法,让们一起再认识空气中氧气含量的测定拉瓦锡实验方案(如图1)利用汞的反应与图2相比,图2的优点_______(一条即可)
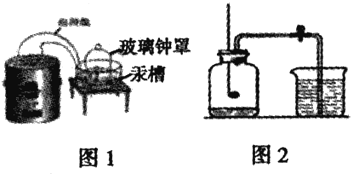
(实验回顾)兴趣小组的同学利用课本中的 实验方案(如图2)测定空气中氧气的含量,但测出的氧气的体积分数明显小于1/5。
请你参与探究:
(提出问题)造成误差的原因是什么?如何改进课本上的实验装置?
(查阅资料)红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度/(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(猜想与假设)
甲同学;可能是导管内原含有空气,后来残留有吸入的水,影响实验的准确性。
乙同学:可能是瓶内残留气体中还有氧气。
你还能作出的猜想是____________。
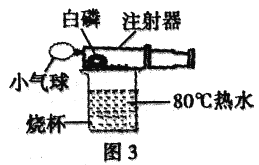
(实验与交流)在老师的指导下,小组同学对课本上的实验装置进行了图3所示的改进(其他仪器忽略)。
(1)甲同学提出应把红磷换为白磷,理由是________________________。
(2)写出白磷燃烧的化学方程式________________________。
(3)与课本上的实验装置相比较,该装置的一个优点是________________________。
(探究与反思)
(4)大家用改进的实验装置进行实验,待注射器冷却、管内白烟消失后,又意外发现注射器内壁附着黄色固体,该黄色固体的主要成分可能是______________________。
(5)为了验证乙同学的猜想,在老师的指导下,兴趣小组 的闻学又利用传感器改进实验装置(如图4),分别用过量的红磷和白磷进行对照实验,并用高能激光笔点燃磷。
①用测量氧气浓度的传感器测得反应后装置内氧气 浓度分别是:红磷为8.7%和白磷为1.0% ,从而证明乙同学的猜想___________(填“正确”或“错误”),但也有同学认为白磷也不能准确测定空气中氧气含量的原因是_________________________________。
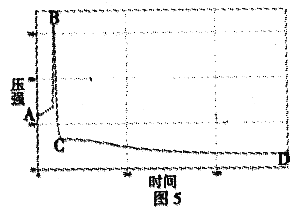
②如图5是白磷燃烧过程中的压强变化趋势,试分析回答:图中AB段变化的原因是______________________; BC段变化的原因是______________________。