题目内容
实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某敞口放置一段时间的盐酸的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。
 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)
测定溶液的pH,得到的数据如下:
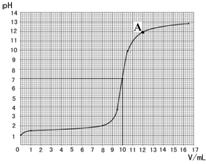
| 加入氢氧化钠 的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
依据表中数据绘制出烧杯中溶液的pH与加入氢氧
化钠溶液体积(V)之间的变化关系图。
(3)根据上图查出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积为 mL,A点所表示的溶液中溶质的化学式为 。
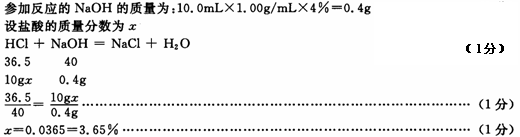
(4)计算此瓶盐酸的溶质质量分数。(请写出计算过程。氢氧化钠溶液的密度按1.0g/mL计算)
(1)8g 192 mL(2分)
(3)10.0mL(1分)NaOH NaCl (1分)
(4)(共3分)
 |

 阅读快车系列答案
阅读快车系列答案(7分)实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某敞口放置一段时间的盐酸的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为 ▲ g,水的体积为 ▲ mL(水的密度近似看作1g/cm3)。
 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)
测定溶液的pH,得到的数据如下:
|
加入氢氧化钠 的体积/mL |
0 |
1.0 |
8.0 |
9.5 |
10.5 |
12.0 |
16.5 |
|
烧杯中溶液pH |
1.0 |
1.3 |
2.0 |
3.9 |
9.9 |
11.9 |
12.8 |
依据表中数据绘制出烧杯中溶液的pH与加入氢氧
化钠溶液体积(V)之间的变化关系图。
(3)根据上图查出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积为 ▲ mL,A点所表示的溶液中溶质的化学式为 ▲ 。
(4)计算此瓶盐酸的溶质质量分数。(请写出计算过程。氢氧化钠溶液的密度按1.0g/mL计算)
▲
实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某敞口放置一段时间的盐酸的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。
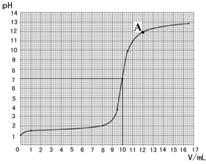 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)
测定溶液的pH,得到的数据如下:
| 加入氢氧化钠 的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
依据表中数据绘制出烧杯中溶液的pH与加入氢氧
化钠溶液体积(V)之间的变化关系图。
(3)根据上图查出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积为 mL,A点所表示的溶液中溶质的化学式为 。
(4)计算此瓶盐酸的溶质质量分数。(请写出计算过程。氢氧化钠溶液的密度按1.0g/mL计算)