题目内容
【题目】t℃时,烧杯中盛有20g水。对其进行如下操作,分别得到t℃时溶液A和溶液B。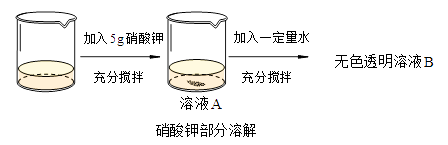
①上述溶液中溶质的化学式是。
②充分搅拌使用的仪器名称是。
③溶液A是(选填“饱和”或“不饱和”)溶液。
④要使部分硝酸钾固体全部溶解,还可以采用的方法为。
⑤t℃,未溶解的硝酸钾为1g,则该温度下,硝酸钾的溶解度为g/100g水。
⑥请写出溶液A与溶液B的溶质质量分数的大小关系并分析理由。
【答案】KNO3;玻璃棒;饱和;升高温度;20;如溶液B为t℃饱和溶液,则溶液A和B溶质质量分数相等。如溶液B为t℃不饱和溶液,则溶液A的溶质质量分数大于溶液B。
【解析】①由题意可知,溶液中溶质是硝酸钾,化学式是KNO3;
②充分搅拌使用的仪器名称是玻璃棒;
③由于溶液A中有未溶解的硝酸钾,所以溶液A是饱和溶液;
④由于硝酸钾的溶解度随温度的升高而增大,所以要使部分硝酸钾固体全部溶解,还可以采用的方法为升高温度;
⑤t℃,未溶解的硝酸钾为1g,由题意可知,4g的硝酸钾溶解在20g中形成了饱和溶液,则该温度下,硝酸钾的溶解度为20g;
⑥溶液A与溶液B的溶质质量分数的大小关系是:如溶液B为t℃饱和溶液,则溶液A和B溶质质量分数相等.如溶液B为t℃不饱和溶液,则溶液A的溶质质量分数大于溶液B.
故答为:KNO3;玻璃棒;饱和;升高温度;20;如溶液B为t℃饱和溶液,则溶液A和B溶质质量分数相等.如溶液B为t℃不饱和溶液,则溶液A的溶质质量分数大于溶液B.
【考点精析】解答此题的关键在于理解溶液、溶质和溶剂的相互关系与判断的相关知识,掌握溶液的质量 = 溶质的质量 + 溶剂的质量;溶液的体积 ≠ 溶质的体积 + 溶剂的体积;溶液的名称:溶质的溶剂溶液(如:碘酒—碘的酒精溶液)固体、气体溶于液体,液体为溶剂;溶质和溶剂的判断:有水,水有溶剂;无水,量多为溶剂,以及对饱和溶液和不饱和溶液的理解,了解饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案