题目内容
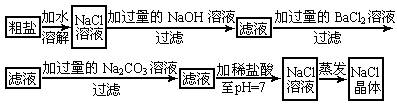
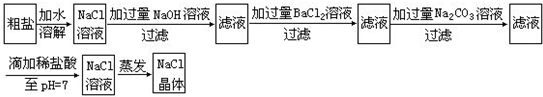
41、在除杂质的实验操作中,为了将溶液中的杂质完全除去,通常需加入过量的除杂质试剂.某校化学课外活动小组为了除去粗盐中含有的少量Na2SO4、MgCl2,设计了下列实验步骤:
试简要说明:
(1)加入过量的BaCl2溶液的原因是
(2)加入过量的Na2CO3溶液的原因是
(3)滴加稀盐酸直至pH=7的目的是

试简要说明:
(1)加入过量的BaCl2溶液的原因是
完全除去Na2SO4(或SO42-)杂质
;(2)加入过量的Na2CO3溶液的原因是
完全除去剩余的BaCl2(或Ba2+)
;(3)滴加稀盐酸直至pH=7的目的是
刚好完全除去剩余的Na2CO3(或CO32-)和NaOH(或OH-)
.分析:可根据滤液的成分及物质的化学性质,结合除杂的原理进行分析判断.
解答:解:(1)加入过量氢氧化钠溶液,过滤所得滤液中含有硫酸钠、氯化钠、剩余的氢氧化钠,
所以加入过量的氯化钡溶液,可发生反应:BaCl2+Na2SO4══BaSO4↓+2NaCl,所以过量的目的就是将硫酸根完全除去.
(2)加入过量氯化钡溶液,过滤后所得滤液中含有氯化钠、氢氧化钠和剩余的氯化钡,
加入过量碳酸钠溶液,发生反应:BaCl2+Na2CO3═BaCO3↓+2NaCl,所以加入过量的碳酸钠的目的是将钡离子完全除去.
(3)加入过量碳酸钠溶液,过滤后所得滤液中含有氢氧化钠和剩余的碳酸钠,
加入盐酸,发生反应:2HCl+Na2CO3═2NaCl+CO2↑+H2O;NaOH+HCl═NaCl+H2O,当pH值为7时,表示碳酸钠和氢氧化钠恰好完全反应.
故答案为:(1)完全除去Na2SO4(或SO42-)杂质;
(2)完全除去剩余的BaCl2(或Ba2+);
(3)刚好完全除去剩余的Na2CO3(或CO32-)和NaOH(或OH-).
所以加入过量的氯化钡溶液,可发生反应:BaCl2+Na2SO4══BaSO4↓+2NaCl,所以过量的目的就是将硫酸根完全除去.
(2)加入过量氯化钡溶液,过滤后所得滤液中含有氯化钠、氢氧化钠和剩余的氯化钡,
加入过量碳酸钠溶液,发生反应:BaCl2+Na2CO3═BaCO3↓+2NaCl,所以加入过量的碳酸钠的目的是将钡离子完全除去.
(3)加入过量碳酸钠溶液,过滤后所得滤液中含有氢氧化钠和剩余的碳酸钠,
加入盐酸,发生反应:2HCl+Na2CO3═2NaCl+CO2↑+H2O;NaOH+HCl═NaCl+H2O,当pH值为7时,表示碳酸钠和氢氧化钠恰好完全反应.
故答案为:(1)完全除去Na2SO4(或SO42-)杂质;
(2)完全除去剩余的BaCl2(或Ba2+);
(3)刚好完全除去剩余的Na2CO3(或CO32-)和NaOH(或OH-).
点评:除杂要遵循“不增、不减、过量、易分”的原则,即除去杂质的同时,要保证不能使所需物质的量减少,但可以增加,更不能引入新的杂质,所加试剂一般要求过量,以便将杂质除尽,并且,生成物、所选试剂与所需物质要容易分离.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目