题目内容
【题目】一包固体粉末可能含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的三种物质。某兴趣小组为确定其组成设计并进行如下实验:
(1)取少量该固体粉末于烧杯中,加足量的水,溶解,过滤,得到白色滤渣和无色滤液,则滤渣中一定含有_______。
(2)向(1)中所得滤液滴加无色酚酞溶液,溶液变红,说明滤液显______(填“酸性”“碱性”或“中性”);
(3)向(2)所得溶液中滴加足量稀盐酸,观察到_______,说明原固体粉末中一定含有Na2CO3;
(4)为进一步确定其成分,同学们又进行如图探究,实验测得固体B中含15.0g氯元素。
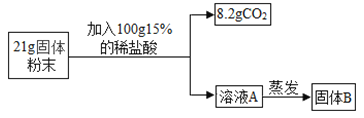
①上述实验中一定发生的化学反应是:_______和![]() ;
;
②最终确定该固体由_________组成。
【答案】CaCO3 碱性 有气泡冒出 ![]() CaO、Na2CO3 和NaCl
CaO、Na2CO3 和NaCl
【解析】
碳酸钙难溶于水,氧化钙和水反应生成氢氧化钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,酚酞遇氢氧化钠、碳酸钠会变红色,碳酸钠和酸反应会生成二氧化碳。
(1)取少量该固体粉末于烧杯中,加足量的水,溶解,过滤,得到白色滤渣和无色滤液,滤渣中一定含有碳酸钙;
(2)向(1)中所得滤液滴加无色酚酞溶液,溶液变红,说明滤液显碱性;
(3)向(2)所得溶液中滴加足量稀盐酸,观察到有气泡产生,说明原固体粉末中一定含有Na2CO3;
(4)①设生成8.2g二氧化碳需要碳酸钠的质量为x,
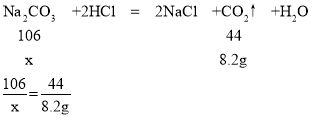
x=19.7g,
而粉末的质量是21g,所以生成8.2g二氧化碳不需要碳酸钙,说明碳酸钙是氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,因此粉末中加入稀盐酸一定有氧化钙与盐酸的反应,化学方程式为:![]() ;
;
②100g15%的盐酸含有氯元素的质量为:100g×15%×![]() =14.6g,
=14.6g,
而固体B中含有15g氯元素,则混合物中一定含有含氯元素的物质,即一定含有氯化钠,所以固体粉末的组成可能是:Na2CO3、NaCl、CaO。
故答案为:(1)碳酸钙;
(2)碱性;
(3)有气泡冒出;
(4)①![]() ;②Na2CO3、NaCl、CaO。
;②Na2CO3、NaCl、CaO。