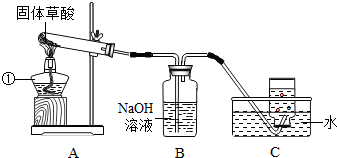
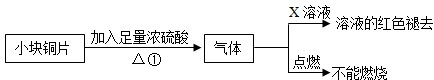
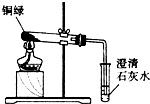
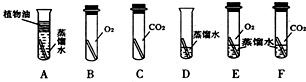
题目内容
(2010?黄石)将11g含少量杂质(杂质不溶于水,也不溶于酸)的碳酸钠固体,加入到43.8g盐酸溶液中,恰好完全反应,产生CO气体4.4g,请计算:
(1)原固体中Na2CO3的质量;
(2)反应后的溶液中氯化钠的质量分数.
(1)原固体中Na2CO3的质量;
(2)反应后的溶液中氯化钠的质量分数.
分析:(1)根据气体的质量代入碳酸钠与盐酸反应的化学反应方程式来计算碳酸钠的质量;
(2)根据生成的氯化钠的质量和样品中氯化钠的质量计算反应后溶质的总质量,利用质量守恒计算反应后溶液的质量,最后计算溶质的质量分数.
(2)根据生成的氯化钠的质量和样品中氯化钠的质量计算反应后溶质的总质量,利用质量守恒计算反应后溶液的质量,最后计算溶质的质量分数.
解答:解:(1)设样品中碳酸钠的质量为x,与盐酸反应生成的氯化钠为y,则
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
x y 4.4g
=
=
解得x=10.6g
y=11.7g
纯碱样品中碳酸钠的质量为10.6g
(2)溶液中氯化钠的质量为:11.7g+(11g-10.6g)=12.1g,
溶液的质量为:10.6g+43.8g-4.4g=50g
则反应后所得氯化钠溶液的溶质质量分数
×100%=24.2%,
答:原固体中Na2CO3的质量10.6g,
反应后所得氯化钠溶液的溶质质量分数为24.2%.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
x y 4.4g
| 106 |
| 44 |
| x |
| 4.4g |
| 117 |
| 44 |
| y |
| 4.4g |
解得x=10.6g
y=11.7g
纯碱样品中碳酸钠的质量为10.6g
(2)溶液中氯化钠的质量为:11.7g+(11g-10.6g)=12.1g,
溶液的质量为:10.6g+43.8g-4.4g=50g
则反应后所得氯化钠溶液的溶质质量分数
| 12.1g |
| 50g |
答:原固体中Na2CO3的质量10.6g,
反应后所得氯化钠溶液的溶质质量分数为24.2%.
点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键,学生还应熟悉质量分数的计算.

练习册系列答案
相关题目
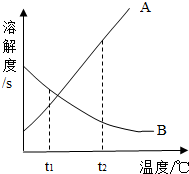 (2010?黄石)已知A、B两种固体的溶解度曲线如图所示,试回答下列问题:
(2010?黄石)已知A、B两种固体的溶解度曲线如图所示,试回答下列问题: