题目内容
现有氯化钠和硝酸钾的固体混合物10.85g,将它们全部放入烧杯中,再加入170g硝酸银溶液恰好完全反应,然后过滤、洗涤、干燥,称得沉淀14.35g,则原固体混合物中硝酸钾的质量为______g,原硝酸银溶液中溶质的质量分数为______.(写出计算过程)
【答案】分析:根据生成的氯化银沉淀的质量,结合反应的化学方程式可计算出原固体混合物中的氯化钠的质量和硝酸银溶液中的硝酸银的质量,进而计算出原混合物中硝酸钾的质量;然后结合溶质的质量分数的计算公式计算出硝酸银溶液中的质量分数即可.
解答:解:设固体混合物中的硝酸银的质量为x,氯化钠的质量为y,
AgNO3+NaCl═AgCl↓+NaNO3
170 58.5 143.5
x y 14.35g
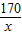 =
=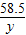 =
=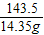
解:x=17g y=5.85g
所以原混合物中硝酸钾的质量为:10.85g-5.85g=5g
原硝酸银溶液中溶质的质量分数为: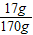 ×100%=10%
×100%=10%
答:原固体混合物中硝酸钾的质量为5g,原硝酸银溶液中溶质的质量分数为10%.
点评:本题难度不是很大,掌握溶液组成的有关计算、利用化学方程式进行计算的方法是正确解答本题的关键.
解答:解:设固体混合物中的硝酸银的质量为x,氯化钠的质量为y,
AgNO3+NaCl═AgCl↓+NaNO3
170 58.5 143.5
x y 14.35g
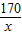 =
=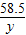 =
=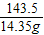
解:x=17g y=5.85g
所以原混合物中硝酸钾的质量为:10.85g-5.85g=5g
原硝酸银溶液中溶质的质量分数为:
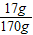 ×100%=10%
×100%=10%答:原固体混合物中硝酸钾的质量为5g,原硝酸银溶液中溶质的质量分数为10%.
点评:本题难度不是很大,掌握溶液组成的有关计算、利用化学方程式进行计算的方法是正确解答本题的关键.

练习册系列答案
相关题目