题目内容
【题目】(7分)现有A~G七种物质,已知A是赤铁矿的主要成分, E的浓溶液有挥发性,G溶液为蓝绿色,它们之间存在如右图所示的转化关系:
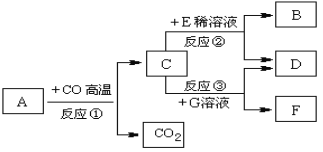
(1)写出下列物质的化学式:D______________;F______________。
(2)工业上常利用反应①的原理来炼铁,写出反应①的化学方程式:________________________。
(3)写出反应②的化学方程式:________________________________________________,
反应类型为____________________反应。
【答案】(1)FeCl2 Cu (2)3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
(3)Fe+2HCl=FeCl2+H2↑ 置换
【解析】
试题分析:A是赤铁矿的主要成分,A是Fe2O3;A与CO高温生成Fe 和CO2,C是Fe;E的浓溶液有挥发性,那么E可能是氨水或者盐酸,又E能与Fe反应,那么E是HCl;G溶液为蓝绿色又能与Fe反应,那么G是含有铜元素的盐;Fe与HCl生成B、D,Fe与CuSO4反应生成F、D,那么D是FeCl2,B是H2,F是Cu,G是CuCl2。(1)略;(2)即Fe2O3与CO高温生成Fe 和CO2;(3)Fe与HCl生成 FeCl2和H2;一种单质和化合物反应生成另一种单质和化合物,属于置换反应。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目