题目内容
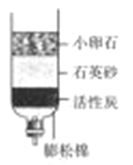
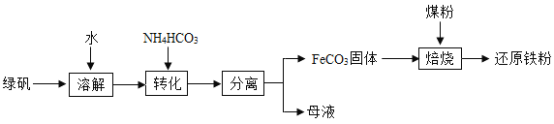
【题目】海水又苦又咸,是因为其中含有大量的Na+、Cl﹣和一些Mg2+、Ca2+、SO42﹣ 等.目前世界上60%的镁是从海水中提取的,其主要步骤如下:
请根据流程图回答:
(1)操作2的名称是_____,试剂Y显酸性,它是_____;
(2)母液中的X是_____,请写出母液中含有的微粒_____;
(3)氯化镁固体的电解属分解反应,写出该反应的化学方程式:_____.
【答案】蒸发结晶 盐酸 NaCl Na+、Cl﹣、Mg2+、Ca2+、SO42﹣、H2O MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
(1)由于氯化镁溶解度受温度的影响变化不大,所以操作2的名称是蒸发结晶;因为生成氯化镁且Y显酸性,它是盐酸;
(2)海水在蒸发溶剂的条件下由不饱和溶液变成过饱和溶液,食盐因此结晶析出;②大部分食盐在结晶析出的同时,也会有很少的其他的晶体从溶液中结晶析出,但溶液中仍旧会有少量的氯化钠,母液中可能含有的微粒是:Na+、Cl﹣、Mg2+、Ca2+、SO42﹣、H2O;
(3)电解氯化镁生成金属镁和氯气,该反应的化学方程式:MgCl2![]() Mg+Cl2↑.
Mg+Cl2↑.
故答案为:(1)蒸发结晶;盐酸;
(2)NaCl;Na+、Cl﹣、Mg2+、Ca2+、SO42﹣、H2O;
(3)MgCl2![]() Mg+Cl2↑.
Mg+Cl2↑.

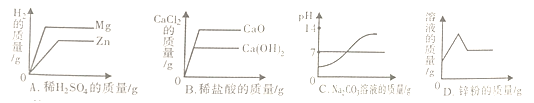
【题目】某同学进行如图两个实验:

(l)甲实验中反应的化学方程式为__________________;
(2)乙实验观察到的现象是__________________;
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(提出猜想)白色沉淀为:Ⅰ.Mg(OH)2;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3。
(实验方案)
实验操作 | 实验现象与结论 |
(1)过滤、洗涤白色沉淀备用; (2)向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为___________。 ②若_________,且无气泡产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________________,猜想Ⅲ成立。 |
(拓展与思考)④如果猜想Ⅲ成立,产生此结果的原因是做甲实验时__________________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是______。